
下列关于电解池的叙述中正确的是( )
A.电解池中的闭合回路仅是由电子的定向移动形成的
B.金属导线中,电子从电源的负极流向电解池的阳极,从电解池的阴极流向电源的正极
C.在电解质溶液中,阴离子向阴极运动,阳离子向阳极运动
D.相同时间内,阳离子在阴极上得到的电子与阴离子在阳极上失去的电子数相等
科目:高中化学 来源:2015安徽望江中学同步课时(人教选修4)2.2影响化学反应速率的因素(解析版) 题型:选择题
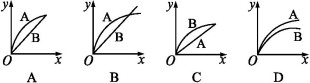
进行如下实验,在A锥形瓶中放入10 g绿豆大小的碳酸钙,在B锥形瓶中放入5 g粉末状的碳酸钙,分别加入50 mL 1 mol·L-1盐酸,下图中能正确表示实验结果的是(注:x—时间,y—锥形瓶中碳酸钙减少的质量)( )
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)第一章检测试卷(解析版) 题型:填空题
磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在一定条件下反应获得。相关热化学方程式如下:
2Ca3(PO4)2(s)+10C(s) 6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
6CaO(s)+P4(s)+10CO(g) ΔH1=+3 359.26 kJ·mol-1
CaO(s)+SiO2(s) CaSiO3(s) ΔH2=-89.61 kJ·mol-1
CaSiO3(s) ΔH2=-89.61 kJ·mol-1
2Ca3(PO4)2(s)+6SiO2(s)+10C(s) 6CaSiO3(s)+P4(s)+10CO(g) ΔH3
6CaSiO3(s)+P4(s)+10CO(g) ΔH3
则ΔH3= kJ·mol-1。
(2)焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)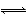 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g) H2O(l) ΔH2=-44 kJ·mol-1;
H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g) 2H2SO4(l) ΔH3=-545 kJ·mol-1。
2H2SO4(l) ΔH3=-545 kJ·mol-1。
则SO3(g)与H2O(l)反应的热化学方程式是 。
(3)大气中的部分碘源于O3对海水中I-的氧化。O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g) IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)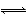 HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq)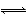 I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
总反应的化学方程式为 ,其反应热ΔH= 。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3电解原理的应用试卷(解析版) 题型:选择题
在铁制品上镀一定厚度的锌层,以下方案设计正确的是( )
A.锌作阳极,镀件作阴极,溶液中含有锌离子
B.铂作阴极,镀件作阳极,溶液中含有锌离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.锌作阴极,镀件作阳极,溶液中含有锌离子
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.3.1电解原理试卷(解析版) 题型:选择题
用惰性电极分别电解下列各物质的水溶液,一段时间后,向剩余电解质溶液中加入适量水能使溶液恢复到电解前的浓度的是( )
A.AgNO3B.Na2SO4 C.CuCl2 D.HCl
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2一次电池二次电池试卷(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(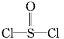 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电解质溶液中混入水,对电池反应无影响
B.金属锂作电池的正极,石墨作电池的负极
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)4.2.2燃料电池试卷(解析版) 题型:填空题
如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
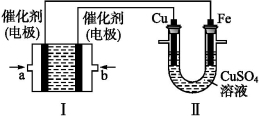
(1)a处应通入 (填“CH4”或“O2”),b处电极上发生的电极反应式是 ;
(2)电镀结束后,装置Ⅰ中溶液的pH (填“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度 ;
(3)电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有 (忽略水解);
(4)在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8 g,则装置Ⅰ中理论上消耗甲烷 L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.4难溶电解质的溶解平衡(解析版) 题型:选择题
某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH,金属阳离子浓度的变化如图所示,据图分析,下列判断错误的是( )
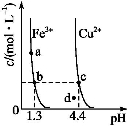
A.Ksp[Fe(OH)3]<Ksp[Cu(OH)2]
B.加适量NH4Cl固体可使溶液由a点变到b点
C.c、d两点代表的溶液中c(H+)与c(OH-)乘积相等
D.Fe(OH)3、Cu(OH)2分别在b、c两点代表的溶液中达到饱和
查看答案和解析>>
科目:高中化学 来源:2015安徽望江中学同步课时练(人教选修4)3.2.3 酸碱中和滴定(解析版) 题型:填空题
如下图是常见仪器的部分结构。
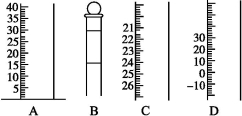
(1)写出仪器名称A ,B ,C ,D 。
(2)使用前需检查是否漏水的仪器有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com