
����Ŀ�������ֽ�������A��B��C������A����ɫ��ӦΪ��ɫ��B��C�dz������������ֽ�������A��B��C��������ס��ҡ���������D��E��F��G��H֮�䷢������ת����ϵ��ͼ����Щ��Ӧ�IJ���ͷ�Ӧ������û��ȫ���������
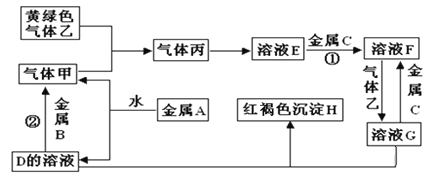
�����������Ϣ�ش��������⣺
��1��д���������ʵĻ�ѧʽ��H_______________����______________��
��2��д�����з�Ӧ�����ӷ���ʽ
��Ӧ��_________________________________________________________________
��Ӧ��_________________________________________________________________
��3��������ҺG�е������ӣ���ȡ������ҺG���Թ��У��μ�KSCN��Һ��������____________��������ҺG�е������ӣ�����ȡ������ҺG���Թ��У��μ�__________���ѧʽ����Һ�������Dz�����ɫ������
���𰸡� Fe(OH)3 Cl2 Fe+2H+ = Fe2++H2�� 2OH��+2Al+2H2O = 2AlO2��+3H2�� ��Һ��ΪѪ��ɫ AgNO3
������������A��ɫ��ӦΪ��ɫ����AΪ����Na����ˮ��Ӧ����NaOH����������DΪNaOH�������ΪH2���������������B��Ӧ�����������ʽ���BΪAl������ɫ������ΪCl2����������Ӧ���ɱ�ΪHCl��HCl����ˮ������EΪ���ᡣ��������������G��Ӧ���ɺ��ɫ����H��Fe(OH)3��������G�к���Fe3+����ת����ϵHCl��C��Ӧ����F��F��������Ӧ��������G��֪����CΪFe������FΪFeCl2������GΪFeCl3��������ʵ����ʽ����⡣
�������Ϸ�����֪AΪNa��BΪAl��CΪFe��DΪNaOH��E�����ᣬFΪFeCl2��GΪFeCl3��H��Fe(OH)3����ΪH2����ΪCl2����ΪHCl����
��1��ͨ�����Ϸ���֪HΪFe(OH)3����ΪCl2��
��2����Ӧ�����������ᷴӦ�����Ȼ�����������������ʽΪFe+2H+ =Fe2++H2������Ӧ���ǽ�����������������Һ��Ӧ����ƫ�����ƺ�����������ʽΪ2OH��+2Al+2H2O��2AlO2��+3H2����
��3��GΪFeCl3�����е�������Ϊ�����ӣ����������ӳ��õ��Լ���KSCN��Һ����������Һ�Ժ�ɫ���������������ӣ�һ������������Һ���飬�����Dz�����ɫ������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ��(��ȥ���ּг������������Լ�����)������������ƾ���(Na2S2O3��5H2O)��ʵ�鲽��������װ�âٵ���ƿ�еμ�80%��ŨH2SO4����ַ�Ӧ�����װ�â��л�����Һ���ᾧ���õ���Ʒ��
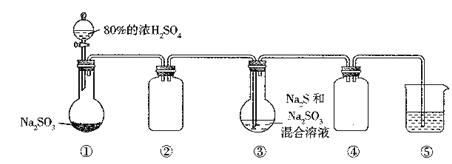
��֪:2Na2S+Na2SO3+3SO2=3Na2S2O3�������жϲ���ȷ����
A. Ӧ��װ�â٣�����H2O2��MnO2����ȡ����O2
B. ʵ������У�װ�âں�װ������������ͬ
C. װ�â��Т�Na2S��Na2SO3���������֮�����Ϊ1:2
D. װ�â���ʢ��NaOH��Һ�������ն����β��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������з����˷ܼ�����ʧ��ƽ��Ҳ�ܻ����������£�ij���˷ܼ��Ľṹ��ʽ��ͼ��ʾ���йظ����ʵ�˵������ȷ����
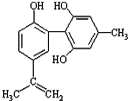
A���������뱽������ͬϵ���FeCl3��Һ����ɫ
B����������KMnO4��Һ����ɫ��ȥ����֤����ṹ�д���̼̼˫��
C���÷����е�����̼ԭ�Ӳ����ܹ�ƽ��
D��1mol�����ʷֱ���Ũ��ˮ��H2��Ӧʱ�������Br2��H2Ϊ4mol��7mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ǵĽ���ϢϢ��أ�Ŀ�ҹ�ͨ�����6����Ⱦ�������Ũ���������������ָ����AQI����SO2��NO2����CO������3���е���Ⱦ�
��1������3������ֱ������������������������������ѧʽ����
��2�����������г�����NaClO2��Һ��Ϊ���ռ�����ͬʱ����������������������������ӦClO2��+2SO32��2SO42��+Cl�� �� �÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ��
��3�����÷�Ӧ6NO2+8NH3�T7N2+12H2O���ɵ�صķ���������ʵ����Ч��������������ŷţ����ỷ����Ⱦ�����ܳ�����û�ѧ�ܣ�װ����ͼ��ʾ��д���缫A�ĵ缫����ʽ �� ���������4.48L������ʱ��ͨ���缫B�ĵ�����Ϊ �� 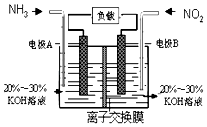
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015������������������Ű�ҹ��ж�����������������β������ɿ�����Ⱦ����Ҫԭ������β����������Ҫԭ��Ϊ��
2NO��g��+2CO��g�� ![]() 2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ1��ʾ��
2CO2��g��+N2��g�������ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯������ͼ1��ʾ��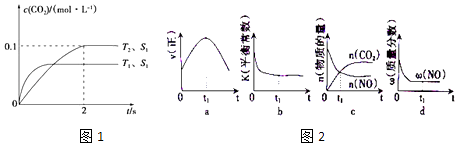
��1���÷�Ӧ�ġ�H0��ѡ�����������������
��2����T2�¶��£�0��2s�ڵ�ƽ����Ӧ����v��N2��= ��
��3�����������������һ��ʱ����������漴�����ѧ��Ӧ���ʣ��������ı����S1��S2 �� ��ͼ1�л���c��CO2����T1��S2�����´ﵽƽ������еı仯���ߣ�
��4�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�ͼ2��ʾ��ͼ��ȷ����˵����Ӧ��t1ʱ�̴��ڻ�ѧƽ��״̬����������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣����е�ÿ����ĸ��ʾһ�ֶ�����Ԫ��,�ش��������⣺
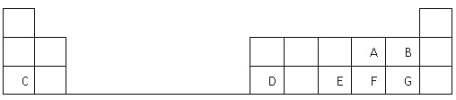
��1������C��ԭ�ӽṹʾ��ͼ__________��
��2��D��Ԫ�����ڱ��е�λ���ǵ������ڵ�________�塣
��3��A��B��E��F��G����Ԫ�����γɵ���̬�⻯�����ȶ�����__________���ѧʽ����
��4��E��FԪ�ص�����������Ӧˮ��������Խ�ǿ����____________���ѧʽ����
��5��д��C��G�γɵĻ�����ĵ���ʽ______________________��
��6��C��D��F��G�ļ����Ӱ뾶��С��ϵ��__________________ �������ӷ��ű�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС������������װ�úͷ����ⶨ������SO2����������Ϊ���еIJ�����
��� | A | B | C |
װ�� |
|
|
|
ԭ�� | ͨ��V���������ⶨ���ɳ��������� | ��KMnO4��Һ�պ���ɫʱ���ⶨͨ����������V | ͨ��V���������ⶨU�����ӵ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���ѧ��Ӧ������Ҫ���塣
��1����֪һ�������£���ӦN2+3H2![]() 2NH3Ϊ���ȷ�Ӧ;��
2NH3Ϊ���ȷ�Ӧ;��
����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��
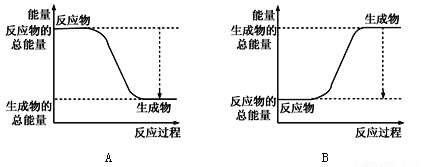
�ڸ����±����ݣ���������1molNH3ʱ�÷�Ӧ�ų�������Ϊ______kJ��
��ѧ�� | H-H | N��N | N-H |
�Ͽ�1mol�������յ����� | 436kJ | 946kJ | 391kJ |
��һ���¶��£���3molH2��1molN2ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����5min�ﵽƽ�⣬���c(NH3)=0.4mol/L����0��5min��N2��ƽ����ѧ��Ӧ����v(N2)=______����Ӧ��ʼ��ƽ��ʱ��������ʵ���֮��Ϊ__________�����ﵽƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0 ������p0��p����ʾ�ﵽƽ��ʱH2��ת����Ϊ__________��
�� �ڢ۷�Ӧ�����£��ܹ��жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����______________��
A�������ڻ�������ܶȲ���
B����������ѹǿ����
C����λʱ��������n mol N2 ��ͬʱ����2n mol NH3
D�� v (N2)��2v(NH3)
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���A��B��C��D���ֽ������±���װ�ý���ʵ�飺

��װ�ü���SO![]() ��________ ���ƶ����A����B������
��________ ���ƶ����A����B������
�����ֽ��������ǿ������˳����_____________��
����װ�ñ��еĵ缫Ϊ������ȵ�������ͭ������ع���һ��ʱ���ȡ��ϴ����������������缫������Ϊ6g��������ͨ�����ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��nH2O���ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽������ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣����ͱ���ԭ��________________________��
��2��Ϊ�ⶨij�̷��нᾧˮ����������ͼ��װ����������������ԡ���ʯӢ�����ܣ������˿���K1��K2����������Ϊװ��A�����أ���Ϊ80.120g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ 107.020g������ͼ���Ӻ�װ�ý���ʵ�顣
������B��������____________________��
��ʵ���������Ϊ�� ��һ���� ��K1��K2������ͨ��N2 �� �ڶ�������ȼ�ƾ��ƣ�С�ļ��ȣ���������Ϩ��ƾ��� �����IJ�����ȴ������ �� ���岽���ر�K1��K2 �� ������������A �� ���ʣ� ��һ������ͨ��N2 ��Ŀ����________________________��
�ظ������������裬ֱ��A���أ���Ϊ95.320g��
�ۼ����̷���ѧʽ�нᾧˮn=________________������һλС������
��3��ͬѧ�Dz������Ͽ�֪�����������ڸ����·ֽ����ΪFe2O3 �Լ� SO2��SO3��Ϊ����֤���������ֽ�����������Ѻ��ص�װ��A������ͼ��ʾ��װ���У���K1��K2������ͨ��N2����ǿ�ȳ�ַ�Ӧ���в�������Ϊ _______ ɫ��ĩ��![]()
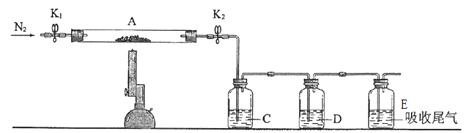
C��D�е���Һ����Ϊ________ ��________�����ţ���
a��Ʒ�� b��NaOH c��BaCl2 d��Ũ����
��4�����Ͻ���������һ������̬�ȣ����ǿ�ѧ�������װ���������ǻ�ѧʵ���е���Ҫ����֮һ,������32��ʵ��װ�������Լ��IJ�����_______________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com