
| A. | Ca(NO3)2 | B. | NaCl | C. | H2O | D. | KOH |
科目:高中化学 来源: 题型:填空题
| 元素 | Al | B | Be | C | Cl | X | Li |
| 电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 |
| 元素 | Mg | N | Y | O | P | S | Si |
| 电负性 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
 、该物质中的化学键为离子键、共价键.
、该物质中的化学键为离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
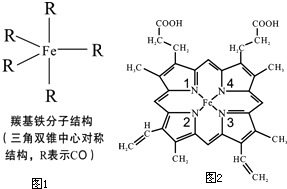 Fe、C、N、O、H可以组成多种物质.回答以下问题:
Fe、C、N、O、H可以组成多种物质.回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.
已知磺酰氯(SO2Cl2)是一种有机氯化剂,SO2(g)+Cl2(g)=SO2C12(g)△H<0,SO2Cl2是一种无色液体,熔点-54.1℃,沸点69.1℃,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 五氯化磷(PCl5) | B. | 次氯酸(HClO) | C. | 氯化硫(S2Cl2) | D. | 白磷(P4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol有机物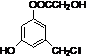 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 分别能与1molNa2CO3、2molNa、3molBr2、4molNaOH反应 | |
| B. | 有机物分子 与银氨溶液作用后仍具有光学活性 与银氨溶液作用后仍具有光学活性 | |
| C. | 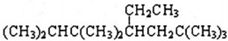 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 的正确命名为2,3,3,6,6-五甲基-4-乙基庚烷 | |
| D. | 2-甲基-1,3-丁二烯在一定温度下和Br2按物质的量之比1:1发生加成反应,所得产物主要有三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com