
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、乙烯的结构简式:C2H4 | ||
B、中子数为146、质子数为92的铀(U)原子
| ||
C、氯原子的结构示意图: | ||
D、氢氧根离子的电子式: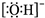 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水中一水合氨的电离方程式:NH3?H2O═NH4-+OH- | |||
| B、氢氧化钡溶液跟稀硫酸反应的离子方程式:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |||
C、苯和硝酸反应的化学方程式: +HNO3 +HNO3
 +H2O +H2O | |||
| D、25℃、101 kPa时,1 g甲醇完全燃烧生成CO2和液态水放出22.68 kJ的热量,所以反应物的能量低于生成物的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
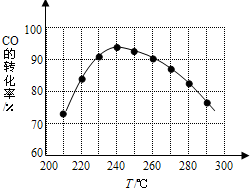 二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的工艺主要发生三个反应:
二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以CO和H2为原料生产CH3OCH3的工艺主要发生三个反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(OH-)/c(NH3?H2O) |
| B、c(NH3?H2O)/c(OH-) |
| C、c(H+)和c(OH-)的乘积 |
| D、c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com