
| 物质 | 组成和结构信息 |
| a | 仅由A和E两元素组成的离子化合物 |
| b | 由D和E组成的离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 化学组成为A2GD4 |
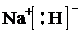 ;
; ;
;分析 A、B、D、E、F、G为短周期元素,非金属元素A最外层电子数与其周期数相同,则A为H元素;E+与D2-具有相同的电子数,则E处于IA族,D处于ⅥA族,则E为Na、D为O元素;B在D中充分燃烧生成其最高价化合物BD2,B的最高正化合价为+4,B的最外层电子数是其所在周期数的2倍,则B处于第二周期,故B为碳元素;A在F中燃烧,产物溶于水得到种强酸,则F为Cl,G与D最外层电子数相等,所以G是硫,由此分析解答.
解答 解:(1)A是氢,在周期表中的位置是第一周期第ⅠA族,故答案为:第一周期第ⅠA族;
(2)电子层数越多半径越大,电子层数相同时,核电荷数越多半径越小,所以离子半径大小为:r(S2-)>r(O2-)>r(Na+),故答案为:r(S2-)>r(O2-)>r(Na+);
(3)碳、氯、硫三种元素中,最高价氧化物对应的水化物中酸性最强的物质是高氯酸,碳、氧、硫三种元素氢化物中水与水分子间存在氢键,沸点异常的高,故答案为:高氯酸;H2O;
(4)氢与碳形成的所有烃中,等质量时耗氧量最大,也就是含氢量最高的甲烷,甲烷的分子构型为正四面体形,故答案为:正四面体形;
(5)①a仅由氢和钠两元素组成的离子化合物是氢化钠,电子式为: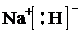 ,故答案为:
,故答案为: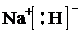 ;
;
②b由氧和钠组成的离子化合物,且原子数之比为1:1,是过氧化钠,78g过氧化钠的物质的量为1mol,含有阴离子过氧根离子的物质的量为1mol,故答案为:1;③③c化学组成为COCl2,其电子式为 ,故答案为:
,故答案为: ;
;
④单质碳与浓硫酸反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
点评 本题考查元素化合物推断,题目涉及的知识点较多,侧重于考查学生对所学知识点综合应用能力,题目难度中等.


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | 简单阴离子还原性X大于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入X溶液浑浊,通入Y无明显现象 | B. | 通入X现象不明显,通入Y溶液浑浊 | ||
| C. | 通入X和Y溶液均无明显现象 | D. | 通入X和Y溶液均浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1mol O2分子的质量等于1mol氧原子的质量 | |
| D. | 24g O2分子和24g O3分子所含的氧原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
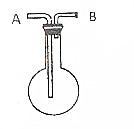 利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)
利用如图所示的装置收集以下7种气体(图中烧瓶位置不得移动)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )
下面如图的分子酷似企鹅,化学家Chris Scotton将该分子以企鹅来取名为Penguinone.下列有关Penguinone的说法正确的是( )| A. | Penguinone的分子式为C10H12O | |
| B. | Penguinone的同分异构体中不可能有芳香醛 | |
| C. | Penguinone分子1mol能与3molBr2发生加成反应 | |
| D. | .Penguinone分子中所有碳原子可能处于同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
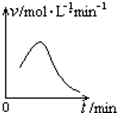 已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示.
已知氯酸钾和亚硫酸氢钠发生氧化还原反应时,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
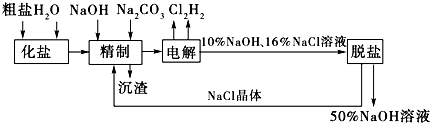
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com