
| 弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
| 电离平衡常数 | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 | 1.8×l0-5 |


科目:高中化学 来源: 题型:
| 反应时间/min | n[CO]/mol | n[H2O]/mol |
| 0 | 1.8 | 0.9 |
| 2 | 1.2 | x |
| 4 | y | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HCOOC2H5 |
| B、CH3COOCH3 |
| C、HCOOCH3 |
| D、CH3COOC2H5 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序可以为、NaOH溶液BaCl2溶液,碳酸钠溶液,过滤后加盐酸 |
| B、第②步中结晶出的MgCl2?6H2O可在蒸发皿中加热制无水MgCl2 |
| C、在第④步中的反应离子方程式为Br2+SO2+2H2O=2H++SO42-+2HBr |
| D、第⑤步涉及的分离操作有过滤、萃取、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a≤b-1 |
| B、在滴酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+)=c(Cl-) |
| C、常温下,某硫酸溶液的pH=3,升高其温度,溶液pH增大 |
| D、相同温度、相同体积、相同物质的量浓度的KI和KF溶液中,离子总数前者大于后者 |
查看答案和解析>>
科目:高中化学 来源: 题型:
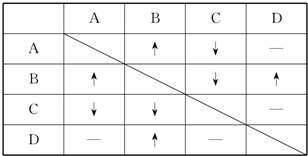
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com