
| A. | 99℃时,Kw=l×l0-12 | |
| B. | pH减小的原因是HSO4-离子发生了水解 | |
| C. | 随温度的升高而增大 | |
| D. | 溶液中,水电离出的c(H+)=10-10mol/L |
分析 99℃时,纯水的pH=6,氢离子浓度增大,此时Kw=l×l0-12,说明升高温度促进水的电离,加入适量NaHSO4固体,pH=2,说明溶液呈酸性,原因是NaHSO4═Na++H++SO42-,以此解答该题.
解答 解:A.蒸馏水的pH=6,说明c(H+)=c(OH-)=1×10-6mol•L-1,水的离子积Kw=1×10-12,故A正确;
B.pH=2,原因是NaHSO4═Na++H++SO42-,故B错误;
C.由于水的电离过程为吸热反应,升高温度,促进了水的电离,水的电离程度会增大,故C正确;
D.水电离出来的氢离子的浓度等于溶液中氢氧根的浓度,c(H+)=c(OH-)=$\frac{1×1{0}^{-12}}{0.01}$mol/L=1×10-10mol•L-1,故D正确.
故选B.
点评 本题考查了水的电离,为高频考点,侧重考查学生的分析、计算能力,题目难度中等,注意水的离子积常数与溶液的温度有关,明确影响水的电离的因素即可解答,试题基础性强,有利于对学生灵活运用基础知识解决实际问题的能力的培养


科目:高中化学 来源: 题型:推断题
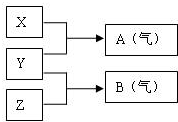 X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:请针对以下两种不同的情况回答:
X、Y、Z为三种不同短周期非金属元素的单质.在一定条件下发生如下反应:请针对以下两种不同的情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化还原反应中一定有元素化合价的升降 | |
| B. | 离子化合物这一定含有金属元素 | |
| C. | 置换反应一定是金属单质与盐酸类之间的反应 | |
| D. | 在常温和101kPa,1mol任何气体的体积约为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉不需要密封保存 | |
| B. | FeCl2溶液保存时加入少量铁粉 | |
| C. | 镁条应保存在煤油中 | |
| D. | NaOH溶液应保存在配有玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2气体中含有的少量杂质SO2可通过饱和Na2CO3溶液除去 | |
| B. | NaOH溶液中含有少量的Ba(OH)2可加入适量的Na2SO4过滤除去 | |
| C. | K2CO3固体中含有少量的NaHCO3杂质可用加热的方式提纯 | |
| D. | Cu粉中含有的少量杂质Fe可加入FeCl3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含lmolFeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl- | 正确:Cl2过量,可将Fe2+、I-均氧化 |
| B | 稀硝酸中加过量铁粉:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | 正确:过量的Fe还原了Fe3+ |
| C | 过量SO2通入到NaClO 溶液中:ClO-+SO2+H2O═HSO3-+HClO | 正确:说明酸性:H2SO3强于HClO |
| D | Mg(HCO3)2溶液与足量的NaOH 溶液反应:Mg2++HCO3-+OH-═MgCO3↓+H2O+CO32- | 正确:酸式盐与碱反应生成正盐和水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①CH3COOH | ②H2CO3 | ③H2S | ④H3PO4 |
| K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com