
����Ŀ��Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g��+3H2��g��2NH3��g����H=��93.0kJ/mol��
���ݱ�����һ�������£�2N2��g��+6H2O��l��4NH3��g��+3O2��g����H=+1530.0kJ/mol��
��1��������ȼ���ȡ�H=kJ/mol��
��2���ں��º�ѹװ���н��й�ҵ�ϳɰ���Ӧ������˵����ȷ���� ��
A.����������ٱ仯������ƽ��
B.�����ܶȲ��ٱ仯����δƽ��
C.ƽ�����װ����ͨ��һ����Ar��ѹǿ���䣬ƽ�ⲻ�ƶ�
D.ƽ���ѹ��װ�ã����ɸ���NH3
��3���ں��º���װ���н��кϳɰ���Ӧ��
�ٱ�ʾN2Ũ�ȱ仯�������� ��
��ǰ25min �ڣ���H2Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������ ��
����25minĩ�պ�ƽ�⣬��ƽ�ⳣ��K= ��
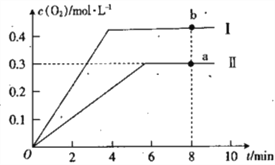
��4���ڵ�25min ĩ�����������������䣬�����¶ȣ��ڵ�35minĩ�ٴ�ƽ�⣮ƽ���ƶ�������H2Ũ�ȱ仯��1.5molL��1 �� ��ͼ�л�����25min��40min NH3Ũ�ȱ仯���� �� 
��5����֪�����£�NH4+��ˮ�ⳣ��Ϊ1.0��10��9 �� ��0.1mol/L NH4Cl��ҺpH= �� ������NH4+ˮ���NH4+Ũ�ȵ�Ӱ�죩
���𰸡�
��1����286.0
��2��A,D
��3��C,0.12mol/��L?min��,0.15
��4��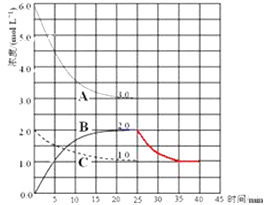
��5��5
���������⣺��1��ȼ����Ϊ1mol������ȫȼ�յõ��ȶ����������ͷŵ���������һ����Ӧ�� ![]() ���ڶ�����Ӧ��
���ڶ�����Ӧ�� ![]() �����ɵõ�������ȼ���ȷ���ʽ��H2��g��+
�����ɵõ�������ȼ���ȷ���ʽ��H2��g��+ ![]() O2��g��=
O2��g��= ![]() H2O��l������H=����286.0kJ/mol��
H2O��l������H=����286.0kJ/mol��
���Դ��ǣ���286.0��
��2��A���ϳɰ���Ӧǰ�����������ͬ�����������ʱ���õ���ѧƽ��״̬����A��ȷ��
B�� ![]() �������������䣬���ڷ�Ӧǰ�����������ͬ����ѹ������������ɱ䣬��ѧƽ���ƶ�ʱ���ܶ���֮�仯�����ܶȲ���ʱ���ﵽ��ѧƽ��״̬����B����
�������������䣬���ڷ�Ӧǰ�����������ͬ����ѹ������������ɱ䣬��ѧƽ���ƶ�ʱ���ܶ���֮�仯�����ܶȲ���ʱ���ﵽ��ѧƽ��״̬����B����
C������Ar������ѹǿ���䣬��N2��H2����NH3Ũ�Ƚ��ͣ���Ӧ��Ũ�Ƚ��ʹ�ѧƽ�����淴Ӧ�����ƶ�����C����
D��ƽ��ʱ��ѹ�������ѹǿ����ѧƽ��������Ӧ�����ƶ���NH3Ũ������D��ȷ��
��ѡ��AD��
��3���ٸ��ݺϳɰ���ѧ����ʽ�жϣ�N2Ϊ��Ӧ���Ũ�ȱ仯��H2Ũ�ȱ仯��С����֪����CΪN2Ũ�ȵı仯���ߣ�
���Դ��ǣ�C��
��ǰ25min �ڣ�H2Ũ����6.0 mol/L��Ϊ3.0 mol/L��v= ![]() =
= ![]() =0.12 mol/��Lmin��
=0.12 mol/��Lmin��
���Դ��ǣ�0.12 mol/��Lmin����
��25minĩʱ��N2Ũ��Ϊ1.0mol/L��H2Ũ��Ϊ3.0mol/L��NH3Ũ��Ϊ2.0mol/L����ѧƽ�ⳣ��ΪK= ![]() =
= ![]() =0.15��
=0.15��
���Դ��ǣ�0.15��
��4���ϳɰ�Ϊ���ȷ�Ӧ�������¶Ȼ�ѧƽ�����淴Ӧ�����ƶ�����NH3Ũ����2.0molL��1��Ϊ��1.5molL��1�����¶ȸ�����ʱ��Ũ�ȱ仯�Ͽ죬
���Դ��ǣ� 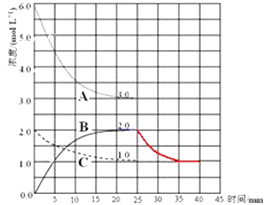 ��
��
��5��ˮ�ⷽ��ʽΪ�� ![]() ��д��ˮ��ƽ�ⳣ������ʽΪ��
��д��ˮ��ƽ�ⳣ������ʽΪ�� ![]() ��������Ũ����һˮ�ϰ�Ũ����ͬ����
��������Ũ����һˮ�ϰ�Ũ����ͬ���� ![]() =1.0��10��9��[NH4+]=0.1mol/�������[H+]=1.0��10��5��pH=5��
=1.0��10��9��[NH4+]=0.1mol/�������[H+]=1.0��10��5��pH=5��
���Դ��ǣ�5��
�����㾫�������ڱ��⿼��Ļ�ѧƽ�ⳣ���ĺ���ͻ�ѧƽ��״̬���ʼ���������Ҫ�˽�ָ��һ�������µĿ��淴Ӧ�����Ӧ���淴Ӧ��������ȣ���Ӧ������и���ֵ�Ũ�Ȳ����״̬����ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч�����ܵó���ȷ�𰸣�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ֻ�ı�һ�������������ж�ͼ��Ľ����ȷ���ǣ�������
A.
��ͼ˵���˷�Ӧ������Ӧ�����ȷ�Ӧ
B.
��ͼ˵��NO2��ת����b��a��c
C.
��ͼ˵����Ӧ��15 minʱ���ı�������������¶�
D.
��ͼ˵��������Dһ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����H2CO3��Һ�е���NaOH��Һ����Һ��H2CO3��HCO3-��CO32-�����ʵ���������(X)����ҺpH�ı仯��ͼ��ʾ[��(X)=[![]() ]��100%]��
]��100%]��
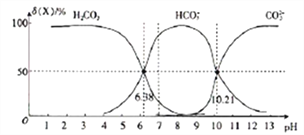
����˵��������ǣ� ��
A. H2CO3��һ������ƽ�ⳣ���Ķ���ֵlgK1(H2CO3)=-6.38
B. pH=7ʱ��c(HCO3-)>c(H2CO3)> c(CO32-)
C. pH=13ʱ��c(Na+)+c(H+)=c(OH-)+2c(CO32-)
D. 25��ʱ����ӦCO32-+H2O![]() HCO3-+OH-��ƽ�ⳣ������ֵ1gK=-3.79
HCO3-+OH-��ƽ�ⳣ������ֵ1gK=-3.79
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO��CO2�ǻ�ʯȼ��ȼ�յ���Ҫ���
��1������0.02 molCO2��0.01molCO�Ļ������ͨ��������Na2O2 ������ܱ������У�ͬʱ���ϵ��õ��ȼ����ַ�Ӧ������������_________g��
��2����֪��2CO(g)+O2(g)=2CO2(g) ��H=-566.0 kJ��mol-1������Eo-o=499.0kJ��mol-1��
�ٷ�Ӧ��CO(g)+O2(g)![]() CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
CO2(g)+O(g)�ġ�H=_________kJ��mol-1��
����֪2500Kʱ�����з�Ӧ��ƽ�ⳣ��Ϊ0.40��ijʱ�̸÷�Ӧ��ϵ�и�����Ũ�����㣺c(CO)��c(O2)=c(CO2)��c(O)�����ʱv(��)_________(�>�� ��������������v���棩��
����֪1500��ʱ�����ܱ������з�����Ӧ��CO2(g)![]() CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
CO(g)+O(g)����Ӧ������O(g)�� ���ʵ���Ũ����ʱ��ı仯��ͼ1 ��ʾ����0~2 min �ڣ�CO2 ��ƽ����Ӧ���� v(CO2)=_________��
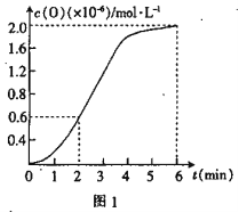
��3����ij�ܱ������з�����Ӧ��2CO2(g)![]() 2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��
2CO(g)+O2(g),1molCO2 �ڲ�ͬ�¶��µ�ƽ��ֽ�����ͼ2 ��ʾ��

�����º��������£��ܱ�ʾ�ÿ��淴Ӧ�ﵽƽ��״̬����_________ (����ĸ)��
A��CO ������������ֲ���
B�������ڻ��������ܶȱ��ֲ���
C�������ڻ�������ƽ��Ħ���������ֲ���
D����λʱ���ڣ�����CO ��Ũ�ȵ�������CO2 ��Ũ��
������ͼ2����1500��ʱ��Ӧ�ﵽƽ��״̬�����������Ϊ1L�����ʱ��Ӧ��ƽ�ⳣ�� K=_________(����������1 λС��)��
��������ܱ������г���2molCO2(g)��������Ӧ��2CO2(g)![]() 2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
2CO(g)+O2(g)������¶�ΪT��ʱ��������O2�����ʵ���Ũ����ʱ��ı仯������II ��ʾ��ͼ������I ʾ���������II���ı�һ�ַ�Ӧ������c(O2)��ʱ��ı仯����ı��������_________��a�� ������COŨ�ȱ仯��ʾ�ľ���Ӧ���ʹ�ϵΪva(CO)_________(�>����<����=��) vb( CO)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Һ֮����Һ������������Ŀ���Լ��ٵ��ǣ� ��
A.���������B.������C.������D.ͭ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A. �������ļ������ϩ��ȫȼ�գ��������ĵ�O2��
B. C5H11Cl��6��ͬ���칹��
C. ����ϩ����ϩ�������ƣ���ʹ��ˮ��ɫ
D. ��������춡�黥Ϊͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ��ܽ�����������������һ����ɣ�˵���塢�ⵥ�������Ȼ�̼�б���ˮ���ܽ�ȴ�����˵����ȷ����(����)
A. �塢�ⵥ�ʺ����Ȼ�̼�ж�����±��
B. �塢���ǵ��ʣ����Ȼ�̼�ǻ�����
C. Cl2��Br2��I2�ǷǼ��Է��ӣ�CCl4Ҳ�ǷǼ��Է��ӣ���ˮ�Ǽ��Է���
D. ����˵��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com