
【题目】标准状况下,在3支相同体积的试管中分别充有体积比为4:1的2种混合的气体,它们是: ①NO和NO2②NO2和O2③NH3和N2,现将3支试管均倒置于水槽中,充分反应后,试管中溶液物质的量浓度之比为
A. 1:1:1 B. 5:4:4 C. 4:4:5 D. 5:4:5
【答案】D
【解析】假设试管的体积为1L,①NO不与水反应,也不溶于水,NO2与水反应:3NO2+H2O=2HNO3+NO,NO2的体积为1/5L,生成HNO3的物质的量为![]() mol,气体体积减少
mol,气体体积减少![]() ,即溶液的体积为
,即溶液的体积为![]() ,硝酸的物质的量浓度为1/22.4mol·L-1;②发生4NO2+O2+2H2O=4HNO3,水充满整个试管,溶液的体积为1L,硝酸的物质的量为
,硝酸的物质的量浓度为1/22.4mol·L-1;②发生4NO2+O2+2H2O=4HNO3,水充满整个试管,溶液的体积为1L,硝酸的物质的量为![]() mol,溶液的体积为1L,即硝酸物质的量浓度为
mol,溶液的体积为1L,即硝酸物质的量浓度为![]() mol·L-1;③NH3极易溶于水,N2不溶于水,因此溶质物质的量为
mol·L-1;③NH3极易溶于水,N2不溶于水,因此溶质物质的量为![]() mol,溶液的体积为4/5L,即物质的量浓度为1/22.4mol·L-1;因此三者物质的量浓度为1/22.4:
mol,溶液的体积为4/5L,即物质的量浓度为1/22.4mol·L-1;因此三者物质的量浓度为1/22.4:![]() :1/22.4=5:4:5,故选项D正确。
:1/22.4=5:4:5,故选项D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A.该合金中铜与镁的物质的量之比是2:1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.NO2和N2O4的混合气体中,NO2的体积分数是80%
D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟工业生产制取HNO3设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。

(1)写出装置A中主要反应的化学方程式________________________________;
(2)写出装置B中主要反应的化学方程式_______________________________________;
(3)装置C中浓H2SO4的作用是_______________________________;
(4)请你帮助该化学小组设计实验室制取NH3的另一方案_______________________________,并写出NH3的两种用途:____________________________________________。
(5)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氧化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略未画)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是_________________,由此,该同学得出结论:不能用无水氯化钙代替碱石灰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是国际单位制中的7 个基本物理量之一
B. 失去电子多的还原剂,还原性一定强
C. 根据是否有丁达尔效应将分散系分为溶液、胶体和浊液
D. “A氧化B”与“B被A氧化”,“A被B还原”表达的含义相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验的叙述中正确的是( )
A.向溴水和碘水中分别加入少量CCl4,振荡后静置,下层的颜色都比上层深
B.用过量的NaOH溶液除去FeCl2溶液中的FeCl3
C.用托盘天平准确称取0.400 0 g食盐,配成500 mL浓度为0.020 0 mol·L-1的食盐水
D.某气体能使品红溶液褪色,则该气体一定是SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将2mol A和2mol B两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8mol D,请填写下面空白:
(1)用B表示的平均反应速率为 , A的转化率为 .
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度 , 混合气体平均相对分子质量(填“增大”、“减少”或“不变”).
(3)若开始时只加C和D各 ![]() mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
mol,要使平衡时各物质的物质的量原平衡相等,则还应加入mol B物质.
(4)若向原平衡体系再投入1mol A和1mol B,平衡(填“右移、左移或不移”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冰醋酸加水溶解并不断稀释过程中,溶液导电能力与加入水的体积有如图变化关系: 
(1)“0”点导电能力为0的理由是:
(2)a、b、c三点中电离程度最大的是;电离平衡常数的关系是 . (填“逐渐增大”、“逐渐减小”或“不变”等)
(3)若要使c点溶液中c(CH3COO﹣)、c(H+)均增大,可采取的措施是(任填一种合理的措施即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学方程式中,正确的是( )
A.甲烷的燃烧热△H=﹣890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=﹣890.3kJ/mol
B.一定条件下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3放热akJ,其热化学方程式为:N2(g)+3H2(g)2NH3(g)△H=﹣2akJ/mol
C.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ/mol
D.HCl和NaOH反应的中和热△H=﹣57.3kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=﹣114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知某无色溶液中可能含有Na+、NH4+、Ba2+、Cu2+、SO42﹣、SO32﹣、Cl﹣、Br﹣、CO32﹣中的若干种,为检验其中含有的离子,进行如下实验:
①取10mL溶液,加入足量氯水,无气体产生,再加入CCl4溶液分层,下层为橙红色;
②分液后,往①的上层溶液中加入足量BaCl2和HCl溶液,产生白色沉淀2.33g;
③另取10mL原溶液,加入过量的浓氢氧化钠溶液并加热,收集到标准状况下448mL气体。
回答下列问题:
(1)一定不存在的离子为:____________;
(2)需要通过焰色反应来确定是否存在Na+吗?_________(填“是”或“否”),请简要说明原因_________。
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
(1)FeCl3溶液与金属铜发生反应的化学反应方程式是__________________ ;
(2)某工程师为了从使用过的腐蚀废液中回收铜,并重新获得氯化铁溶液,准备采用下列步骤:
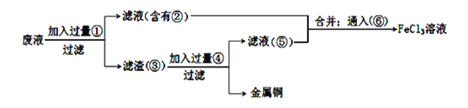
上述实验中加入或生成的有关物质的化学式为②_________ ;④____________;
若向溶液②中加入氢氧化钠溶液,其实验现象为______________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com