
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1分析 (1)1mol H2(g)燃烧生成1molH2O(l)放出的热量为285.8kJ,据此计算分解10mol水消耗的能量;
(2)由CO(g)和CH3OH(l)的燃烧热可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
根据盖斯定律,②-①可得:CH3OH(l)+O2(g)=CO(g)+2 H2O(l);
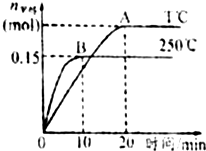
(3)由图可知,250℃先达到平衡,则温度T<250℃,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度反应CO2+3H2?CH3OH+H2O向逆反应方向移动,则正反应为放热反应,
①根据v=$\frac{\frac{△n}{V}}{△t}$计算250℃时,0~10min用H2表示的反应速率;
②温度越高,反应速率越快;
③T时,若3v(CO)=v(H2),没有告诉正逆反应,无法判断平衡状态;
④该反应过程中密度为定值;
⑤根据图象曲线判断平衡时CO2的转化率大小;
(4)根据二氧化碳的转化率计算平衡时各物质的物质的量,恒温恒容下,压强之比对气体物质的量之比;
(5)原电池负极发生氧化反应,正极发生还原反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,由电荷守恒可知,还生成氢离子.
解答 解:(1)1mol H2(g)燃烧生成1molH2O(l)放出的热量为为285.8kJ,分解10mol H2O(l)消耗的能量为:285.8kJ×10=2858kJ,
故答案为:2858;
(2)由CO(g)和CH3OH(l)的燃烧热可得热化学方程式:
①CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
②CH3OH(l)+$\frac{3}{2}$O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJ•mol-1
根据盖斯定律,②-①可得:CH3OH(l)+O2(g)=CO(g)+2 H2O(l),该反应的反应热△H=-726.5kJ•mol-1-(-283.0kJ•mol-1)=-443.5kJ•mol-1,
故热化学方程式为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1,
故答案为:CH3OH(l)+O2(g)=CO(g)+2 H2O(l)△H=-443.5kJ•mol-1;
(3)由图可知,250℃先达到平衡,则温度T<250℃,又温度高时平衡状态CH3OH的物质的量少,则说明升高温度反应CO2+3H2?CH3OH+H2O向逆反应方向移动,则正反应为放热反应,
①250℃时,0~10min时用H2表示的反应速率为:v(H2)=3v(CH3OH)=$\frac{\frac{0.15mol}{2L}}{10min}$×3=0.0225mol/(L•min),故①错误;
②根据分析可知温度T<250℃,温度越高反应速率越快,则该反应在T时生成甲醇的速率比250℃时的小,故②正确;
③T时若3v(CO)=v(H2),没有指出正逆反应,无法判断是否达到平衡状态,故③错误;
④该反应前后都是气体,气体的总质量不变,容器容积不变,则密度始终不变,不能根据密度判断平衡状态,故④错误;
⑤根据图象可知,平衡时甲醇的物质的量:T℃>250℃,甲醇的物质的量越大说明二氧化碳的转化率越高,则平衡时CO2的转化率:T℃时大于250℃,故⑤正确;
故答案为:②⑤;
(4)反应达到平衡后,若CO2转化率为a,则:
CO2(g)+3H2(g)=CH3OH(g)+H2O(g)
起始(mol):1 3 0 0
转化(mol):a 3a a a
平衡(mol):1-a 3-3a a a
根据相同条件下气体的压强之比等于物质的量之比,即(1-a+3-3a+a+a):(1+3)=1-$\frac{a}{2}$,
故答案为:1-$\frac{a}{2}$;
(5)原电池负极发生氧化反应,正极发生还原反应,甲醇在负极失去电子,酸性条件下生成二氧化碳,由电荷守恒可知,还生成氢离子,负极电极反应式为2CH3OH+2H2O-12e-=2CO2+12H+,
故答案为:2CH3OH+2H2O-12e-=2CO2+12H+.
点评 本题考查较为综合,涉及化学平衡计算、反应热与焓变、原电池原理等知识,明确化学平衡及其影响为解答关键,注意掌握电解原理、反应热与焓变的应用,试题培养了学生的分析、理解能力及综合应用能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与任何酸都不反应 | |
| B. | 硅太阳能电池、计算机芯片、光导纤维都用到硅单质 | |
| C. | 硅的性质很稳定,能以单质形式存在于地壳中 | |
| D. | 水泥路桥、门窗玻璃、砖瓦、陶瓷餐具所用材料为硅酸盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
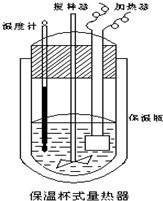 在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )
在如图所示的量热计中,将100mL0.50mol•L-1CH3COOH溶液与100mL0.55mol•L-1NaOH溶液混合,温度从25.0℃升高到27.7℃.已知该量热计的热容常数(量热计各部件每升高1℃所需的热量)是150.5J•℃-1,生成溶液的比热容为4.184J•g-1•℃-1,两溶液的密度均近似为1g•mL-1.下列说法错误的是( )| A. | CH3COOH溶液与NaOH溶液的反应为吸热反应 | |
| B. | 所加NaOH溶液过量,目的是保证CH3COOH溶液完全被中和 | |
| C. | 若量热计的保温瓶绝热效果不好,则所测△H偏大 | |
| D. | CH3COOH的中和热△H为-53.3KJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:
A、B、C、D是中学化学的常见物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示(部分反应中的H2O已略去).请填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com