
X、Y、Z是三种常见元素的单质,甲乙是两种常见的化合物,这些单质和化合物之间存在如图所示的关系,下列说法正确的是 ( ) 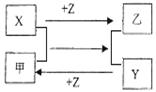
A.X、Y、Z都是非金属单质
B.X、Y、Z中至少有一种是金属单质
C.如果X、Y都为非金属单质,则Z必为金属单质
D.如果X、Y都为金属单质,则Z必为非金属单质
【知识点】框图推断 常见的置换反应 B4 C5 D5
【答案解析】D 解析:A、X可以是金属,如为Al,Mg等,Al+HCl→AlCl3+H2,Z为Cl2;Mg+CO2→C+MgO,Z为O2;Al+Fe2O3→Al2O3+Fe,Z为O2;都可以符合转化关系,X、Y、Z不一定都是非金属单质,故A错误;
B、X、Y、Z可以全部为非金属单质,如:C+SiO2→Si+CO,Z为O2;故B错误;
C、若X、Y为非金属单质,则Z不一定是金属单质,可以是非金属单质,:C+SiO2→Si+CO,Z为O2;故C错误;
D、若X、Y为金属单质,是金属间的置换反应,化合物甲乙一定含金属元素和非金属元素,所以Z必为非金属单质,故D正确;故答案选D
【思路点拨】本题考查了常见的置换反应,如果积累了中学阶段的各种置换反应,直接列举即可解答。


科目:高中化学 来源: 题型:
据报道,锌电池可能取代目前广泛使用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2===2ZnO,原料为锌粒、电解液和空气。则下列叙述正确的是(双选)( )
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-===Zn2+
C.正极发生氧化反应
D.电解液肯定不是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A.Cl2通入FeSO4溶液中 B.CO2通入Ca(OH)2溶液中
C.将AlCl3溶液滴入 NaOH 溶液中 D.SO2通入BaCl2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质用途的说法中,正确的是( )
A.玻璃容器可长期盛放各种酸 B.硝酸常用作金属铜加工前的酸洗
C.碳酸钠可用于治疗胃酸过多 D.三氧化二铁常用于生产红色油漆和涂料
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2(约45%)、Fe2O3(约40%)、Al2O3(约10%)和MgO(约5%)。某同学设计了如下方案,分离样品中各种金属元素。请回答下列问题。
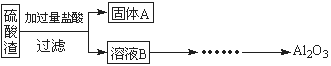
(1)写出溶液B的溶质是 。
(2)参照以下框图形式进一步完成“溶液C”到“Al2O3”的流程(注明试剂、条件和操作) 。

(3)为了分析某硫酸渣中铁元素的含量,先将硫酸渣预处理,把铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。写出反应的离方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.铝制容器可盛装热的浓H2SO4 B.AgI胶体在电场中自由运动
C.K与水反应比Li与水反应剧烈 D.红磷在过量Cl2中燃烧生成PCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
(CH3)2C O+HCN
O+HCN (CH3)2C(OH)CN
(CH3)2C(OH)CN
(CH3)2(OH)CN+CH3OH+H2SO4
CH2 C(CH3)COOCH3+NH4HSO4
C(CH3)COOCH3+NH4HSO4
90年代新法的反应是:
CH3C≡CH+CH3OH+CO CH2
CH2 C(CH3)COOCH3
C(CH3)COOCH3
与旧法比较,新法的优点是(CD)
A. 原料无爆炸危险
B. 原料都是无毒物质
C. 没有副产物,原料利用率高
D. 对设备腐蚀较小
查看答案和解析>>
科目:高中化学 来源: 题型:
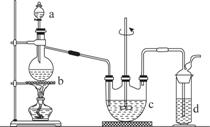
硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革还原剂。它易溶于水,不溶于醇,受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
(1)b中反应的离子方程式为________________,c中试剂为________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是________。
(3)d中的试剂为________。
(4)实验中要控制SO2生成速率,可以采取的措施有___________________________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是______________________。
(6) 所得产品常含有少量Na2SO3和Na2SO4。为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将方案补充完整。(所需试剂从稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)
①取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,________________,若沉淀未完全溶解,并有刺激性气味的气体产生,则可确定产品中含有Na2SO3和Na2SO4。
②为减少装置C中生成Na2SO4的量,在实验过程中应注意的操作顺序是_______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com