
·ÖĪö A£®ÄĘČ¼ÉÕÉś³É¹żŃõ»ÆÄĘ£¬¹żŃõ»ÆÄĘÓė¶žŃõ»ÆĢ¼·“Ӧɜ³ÉŃõĘų£»
B£®Ģ¼ĖįĒāÄĘ·Ö½āÉś³ÉĖ®£»
C£®Öʱø½ŗĢåŹ±²»ÄܽĮ°č£»
D£®Ļ”ŹĶÅØĮņĖį£¬½«ÅØĮņĖį×¢ČėĖ®ÖŠ£»
E£®ČŻĮæĘæÖŠŗ¬ÓŠÉŁĮæÕōĮóĖ®£¬¶ŌŹµŃéĪŽÓ°Ļģ£»
F£®¾ßÓŠČū×Ó”¢»īČūµÄŅĒĘ÷Ź¹ÓĆĒ°ŠčŅŖ²éĀ©£»
G£®ČܽāĄūÓĆ²£Į§°ō½Į°č£¬¹żĀĖĄūÓĆ²£Į§°ōŅżĮ÷£¬Õō·¢ĄūÓĆ²£Į§°ō½Į°č”¢·ĄÖ¹¾Ö²æĪĀ¶Č¹żøߣ®
½ā“š ½ā£ŗA£®ÄĘČ¼ÉÕÉś³É¹żŃõ»ÆÄĘ£¬¹żŃõ»ÆÄĘÓė¶žŃõ»ÆĢ¼·“Ӧɜ³ÉŃõĘų£¬Ōņ²»ÄÜŹ¹ÓĆĆš»šĘ÷£¬Ó¦Ń”ɳĶĮĘĖĆš£¬¹ŹA“ķĪó£»
B£®Ģ¼ĖįĒāÄĘ·Ö½āÉś³ÉĖ®£¬ŌņŹŌ¹ÜæŚÓ¦ĀŌĻņĻĀĒ抱£¬¹ŹB“ķĪó£»
C£®Öʱø½ŗĢåŹ±²»ÄܽĮ°č£¬³öĻÖŗģŗÖÉ«ŅŗĢåŹ±Ķ£Ö¹¼ÓČČ£¬¼ÓČČ”¢½Į°č¾łæÉŹ¹½ŗĢå·¢Éś¾Ū³Į£¬¹ŹC“ķĪó£»
D£®Ļ”ŹĶÅØĮņĖį£¬½«ÅØĮņĖį×¢ČėĖ®ÖŠ£¬²¢²»¶Ļ½Į°č£¬·ĄÖ¹ŅŗµĪ·É½¦£¬¹ŹD“ķĪó£»
E£®ČŻĮæĘæÖŠŗ¬ÓŠÉŁĮæÕōĮóĖ®£¬¶ŌŹµŃéĪŽÓ°Ļģ£¬¶ØČŻŹ±»¹ŠčŅŖ¼ÓĖ®£¬¹ŹEÕżČ·£»
F£®¾ßÓŠČū×Ó”¢»īČūµÄŅĒĘ÷Ź¹ÓĆĒ°ŠčŅŖ²éĀ©£¬ŌņŹ¹ÓĆČŻĮæĘ攢·ÖŅŗĀ©¶·Ź±£¬Ź×ĻČÓ¦¼ģŃéŹĒ·ńĀ©Ė®£¬¹ŹFÕżČ·£»
G£®ČܽāĄūÓĆ²£Į§°ō½Į°č£¬¹żĀĖĄūÓĆ²£Į§°ōŅżĮ÷£¬Õō·¢ĄūÓĆ²£Į§°ō½Į°č”¢·ĄÖ¹¾Ö²æĪĀ¶Č¹żøߣ¬ŌņŌŚ“ÖŃĪµÄĢį“æŹµŃéÖŠ£¬Čܽā”¢¹żĀĖ”¢Õō·¢¶¼ÓƵ½ĮĖ²£Į§°ō£¬¹ŹGÕżČ·£»
¹Ź“š°øĪŖ£ŗE”¢F”¢G£®
µćĘĄ ±¾Ģāæ¼²é»ÆѧŹµŃé·½°øµÄĘĄ¼Ū£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕĪļÖŹµÄŠŌÖŹ”¢ŹµŃé°²Č«”¢ŹµŃé²Ł×÷¼°¼¼ÄÜĪŖ½ā“šµÄ¹Ų¼ü£¬²ąÖŲ·ÖĪöÓėŹµŃéÄÜĮ¦µÄ漲飬עŅāŹµŃéµÄĘĄ¼ŪŠŌ·ÖĪö£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | µē½āČŪČŚµÄAlCl3Éś²śĀĮµ„ÖŹ | |
| B£® | ½«Cl2ÓėHCl»ģŗĻĘųĢåĶعż±„ŗĶŹ³ŃĪĖ®æɵƵ½“æ¾»µÄCl2 | |
| C£® | ÓĆBa£ØOH£©2ČÜŅŗæɼų±šNaCl”¢AlCl3”¢NH4Cl”¢Na2SO4ĖÄÖÖČÜŅŗ | |
| D£® | ÓĆ·ÖŅŗĀ©¶·“ÓŹ³“×ÖŠ·ÖĄė³öŅŅĖį |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 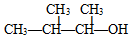 µÄĆüĆūĪŖ£ŗ3-¼×»ł-2-¶”“¼ µÄĆüĆūĪŖ£ŗ3-¼×»ł-2-¶”“¼ | |
| B£® | 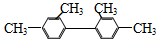 ·Ö×ÓÖŠÖĮÉŁÓŠ11øöĢ¼Ō×Ó“¦ÓŚĶ¬Ņ»Ę½Ćę ·Ö×ÓÖŠÖĮÉŁÓŠ11øöĢ¼Ō×Ó“¦ÓŚĶ¬Ņ»Ę½Ćę | |
| C£® | ōĒ»łµÄµē×ÓŹ½ŹĒ 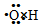 | |
| D£® | ČķÖ¬ĖįŗĶÓĶĖį»„ĪŖĶ¬ĻµĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆ¹ĢĢåÖŠŅ»¶Øŗ¬ÓŠNH4+”¢Cl-”¢SO42-”¢Na+ | |
| B£® | øł¾ŻŅŌÉĻŹµŃ飬ĪŽ·ØČ·¶ØøĆ¹ĢĢåÖŠÓŠCl- | |
| C£® | øĆ¹ĢĢåÖŠÖ»ŗ¬ÓŠNH4+”¢Fe3+”¢SO42-”¢Cl- | |
| D£® | øĆ¹ĢĢåÖŠŅ»¶ØƻӊI-”¢CO32- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŹµŃé²½Öč | ŹµŃéĻÖĻó |
| ¢ŁČ”ÉŁĮæ¹ĢĢåÓŚŹŌ¹ÜÖŠ£¬¼ÓČė×ćĮæÕōĮóĖ® | µĆµ½ĪŽÉ«ČÜŅŗŗĶ°×É«²»ČÜĪļ |
| ¢ŚĻņÉĻŹöŹŌ¹ÜÖŠ¼ÓČė×ćĮæĻ”ŃĪĖį | ÓŠĘųÅŻĆ°³ö£¬°×É«²»ČÜĪļ²æ·ÖČܽā |
| ¢Ū½«²½Öč¢ŚĖłµĆĪļ¹żĀĖ£¬Č”²æ·ÖĀĖŅŗÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠ¼ÓČėÉŁĮæĻõĖįŅųČÜŅŗ | ÓŠ°×É«³ĮµķÉś³É |
| ¢ÜĮķČ”²½Öč¢ŪĖłµĆĀĖŅŗÉŁŠķÓŚŹŌ¹ÜÖŠ£¬ĻņĘäÖŠ¼ÓČė×ćĮæĒāŃõ»ÆÄĘČÜŅŗ | ĪŽĆ÷ĻŌĻÖĻó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
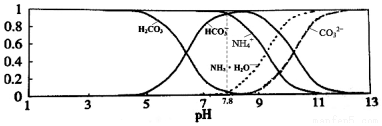
| A£® | µ±ČÜŅŗµÄpH=9Ź±£¬ČÜŅŗÖŠ“ęŌŚĻĀĮŠ¹ŲĻµ£ŗc£ØNH4+£©£¾c£ØHCO3-£©£¾c£ØNH3•H2O£©£¾c£ØCO32-£© | |
| B£® | ĶłøĆČÜŅŗÖŠÖšµĪµĪ¼ÓĒāŃõ»ÆÄĘŹ±NH4+ŗĶHCO3-ÅضČÖš½„¼õŠ” | |
| C£® | NH4HCO3ČÜŅŗÖŠ£ŗc£ØNH4+£©+c£ØNH3•H2O£©+c£ØH+£©=c£ØCO32-£©+c£ØH2CO3£©+c£ØHCO3-£©+c£ØOH-£© | |
| D£® | Ķعż·ÖĪöæÉÖŖ³£ĪĀĻĀKb£ØNH3•H2O£©£¾Ka1£ØH2CO3£© |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
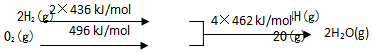
| A£® | C£Øs£©µÄČ¼ÉÕČČ110 kJ/mol | |
| B£® | 2H2£Øg£©+O2£Øg£©ØT2H2O£Øg£©”÷H1=+480 kJ/mol | |
| C£® | C£Øs£©+H2O£Øg£©ØTCO£Øg£©+H2£Øg£©”÷H1=+130 kJ/mol | |
| D£® | Óū·Ö½ā2 mol H2O£Øl£©£¬ÖĮÉŁŠčŅŖĢį¹©4”Į462 kJ µÄČČĮæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH4+”¢SO32-”¢AlO2- | B£® | NH4+”¢Br-”¢CO32- | ||
| C£® | Fe2+”¢S2-”¢SO32- | D£® | NH4+”¢Br-”¢AlO2- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦ĪļµÄŠŌÖŹ | B£® | ·“Ó¦ĪļµÄÅØ¶Č | C£® | ·“Ó¦µÄĪĀ¶Č | D£® | ŹĒ·ńŹ¹ÓĆ“ß»Æ¼Į |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com