考点:原子轨道杂化方式及杂化类型判断,化学方程式的书写,元素电离能、电负性的含义及应用,键能、键长、键角及其应用,“等电子原理”的应用
专题:
分析:(1)原子数相同,电子总数相同的分子,互称为等电子体;
(2)根据3CH
4+2(HB=NH)
3+6H
2O→3CO
2+6H
3BNH
3,可以分析,
a.由CH
4变为CO
2,碳原子杂化类型由sp
3转化为sp,反应前后碳原子的轨道杂化类型已经改变,据此判断;
b.CH
4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+
×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H
2O中价层电子对个数=2+
×(6-2×1)=4,且含有2个孤电子对,所以H
2O的VSEPR模型为四面体,分子空间构型为V型,、CO
2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+
×(4-2×2)=2,所以二氧化碳是直线型结构,据此判断;
c.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I
1(N)>I
1(O)>I
1(C)>I
1(B),据此判断;
d.B一般是形成3个键,(H
3BNH
3)由六元环状化合物(HB=NH)
3通过3CH
4+2(HB=NH)
3+6H
2O→3CO
2+6H
3BNH
3制得,其中1个键是配位键,据此判断;
(3)LiAlH
4和BF
3在一定条件下生成乙硼烷B
2H
6、LiF和AlF
3,根据原子守恒配平方程式;
(4)根据键能越大物质越稳定,可以解释相关问题;
(5)有1个O连着一个B,剩余的两个O分别连着2个B,说明有一个O完全属于B,剩下的两个O,B只占有O的
;硼砂晶体中阴离子[B
4O
5(OH)
4]
2-中一半sp
3杂化形成BO
4四面体;另一种是sp
2杂化形成BO
3平面三角形结构.
解答:
解:(1)原子数相同,电子总数相同的分子,互称为等电子体,与(HB=NH)
3互为等电子体的分子为C
6H
6,故答案为:C
6H
6;
(2)3CH
4+2(HB=NH)
3+6H
2O→3CO
2+6H
3BNH
3,
a.由CH
4变为CO
2,碳原子杂化类型由sp
3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故a错误;
b.CH
4分子中价层电子对=σ 键电子对+中心原子上的孤电子对=4+
×(4-4×1)=4,且不含孤电子对,所以其空间构型是正四面体,H
2O中价层电子对个数=2+
×(6-2×1)=4,且含有2个孤电子对,所以H
2O的VSEPR模型为四面体,分子空间构型为V型,、CO
2分子中价层电子对=σ 键电子对+中心原子上的孤电子对=2+
×(4-2×2)=2,所以二氧化碳是直线型结构,故b正确;
c.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是I
1(N)>I
1(O)>I
1(C)>I
1(B),故c正确;
d.B一般是形成3个键,(H
3BNH
3)由六元环状化合物(HB=NH)
3通过3CH
4+2(HB=NH)
3+6H
2O→3CO
2+6H
3BNH
3制得,其中1个键是配位键,故d正确;
故答案为:a;
(3)LiAlH
4和BF
3在一定条件下生成乙硼烷B
2H
6、LiF和AlF
3,根据原子守恒配平方程式为:3LiAlH
4+4BF
32B
2H
6+3LiF+3AlF
3,故答案为:3LiAlH
4+4BF
32B
2H
6+3LiF+3AlF
3;
(4)因为B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键,根据键能越大物质越稳定,可知自然界中不存在硼单质,硼氢化物也很少,主要是含氧化物,故答案为:B-O键键能大于B-B键和B-H键,所以更易形成稳定性更强的B-O键;
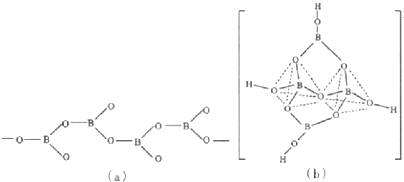
(5)图(a)是一种链状结构的多硼酸根,从图可看出,每个BO
32-单元,都有一个B,有一个O完全属于这个单元,剩余的2个O分别为2个BO
32-单元共用,所以B:O=1:(1+2×
)=1:2,化学式为:BO
2-,从图(b)是硼砂晶体中阴离子的环状结构可看出,[B
4O
5(OH)
4]
2-一半sp
3杂化形成两个四配位BO
4四面体;另一半是sp
2杂化形成两个三配位BO
3平面三角形结构,故答案为:BO
2-;sp
2、sp
3.
点评:本题考查了物质结构及其性质,涉及原子杂化方式的判断、配合物的成键情况、元素周期律、晶胞的计算等知识点,题目综合性较强,注意根据价层电子对互斥理论、构造原理等知识来分析解答,题目难度中等.




 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为H2.为了验证这一事实,某同学拟用如图所示装置进行实验(实验时压强为101kPa,温度为0℃). 纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.
纯碱中常含有少量氯化钠,请设计实验测定纯碱中Na2CO3的质量分数.根据你所设计的方案中的有关的数据,写出纯碱中Na2CO3的质量分数的表达式.