

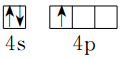
 ;
;分析 (1)基态Ga原子价电子排布式为:4s24p1;
(2)离子晶体晶格能越大,熔点越高;
(3)同一周期元素的第一电离能随着原子序数的增大而增大,但第VA族元素第一电离能大于第VIA元素;
(4)Cu2+与乙二胺所形成的配离子内部含有碳碳非极性键,碳氢、氮氢非极性键和氮与铜离子之间的配位键;
(5)乙二胺分子中氮原子形成4个σ,所以氮原子的轨道的杂化类型为 sp3,乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键,所以乙二胺比三甲胺的沸点高很多;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞中含有铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$求密度;该晶体中铜原子的空间利用率为$\frac{4×\frac{4}{3}×π×{r}^{3}}{{a}^{3}}×100%$.
解答 解:(1)基态Ga原子价电子排布式为:4s24p1,所以基态Ga原子价电子的轨道表达式为 ,故答案为:
,故答案为: ;
;
(2)磷离子的半径大于氮离子的半径,所以GaP的晶格能小于GaN的晶格能,则熔点:GaN>GaP,故答案为:>;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,故答案为:>;
(4)Cu2+与乙二胺所形成的配离子内部含有碳碳非极性键,碳氢、氮氢非极性键和氮与铜离子之间的配位键,而不含离子键,故选:c;
(5)乙二胺分子中氮原子形成4个σ,所以氮原子的轨道的杂化类型为 sp3,乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键,所以乙二胺比三甲胺的沸点高很多,故答案为:sp3;乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键;
(6)Cu的某种晶体晶胞为面心立方结构,晶胞中含有铜原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,根据$ρ=\frac{m}{V}$=$\frac{\frac{4}{{N}_{A}}×64}{{a}^{3}}$=$\frac{256}{{a}^{3}•{N}_{A}}$;该晶体中铜原子的空间利用率为$\frac{4×\frac{4}{3}×π×{r}^{3}}{{a}^{3}}×100%$=$\frac{16π{r}^{3}}{3{a}^{3}}×100%$,故答案为:$\frac{16π{r}^{3}}{3{a}^{3}}×100%$.
点评 本题考查晶胞计算及杂化,氢键等,为高频考点,把握晶体结构、分子结构、物质结构与性质为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度较大.


科目:高中化学 来源: 题型:选择题
| A. | 4.5mol | B. | 5mol | C. | 5.5mol | D. | 6mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
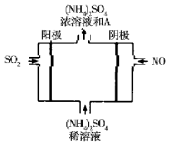 近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:
近年来,雾霾天气频繁出现,严重影响人们的生活和健康.其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等.因此,对PM2.5,SO2,NOx等进行研究具有重要意义.请回答下列问题:| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 物质 温度/℃ | 活性炭 | NO | CO2 | N2 |
| 初始 | 3.000 | 0.10 | 0 | 0 |
| T1 | 2.960 | 0.020 | 0.040 | 0.040 |
| T2 | 2.975 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 玻璃仪器 |
| A | 将溴水滴入KI溶液中,从溶液中分离生成的I2 | 胶头滴管、试管、漏斗、玻璃棒、烧杯 |
| B | 实验室通过蒸馏的方法除去自来水中含有的Cl-等杂质制取蒸馏水 | 酒精灯、圆底烧瓶、冷凝管、尾接管、锥形瓶 |
| C | 用植物油提取溴水中的Br2 | 铁架台、分液漏斗、玻璃棒、烧杯 |
| D | 用浓氨水和氢氧化钠固体制取氨气 | 酒精灯、烧杯、导管、集气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气具有还原性,可用作制冷剂 | |
| B. | 氢氟酸具有弱酸性,可用于蚀刻玻璃 | |
| C. | 浓硫酸具有脱水性,可用于干燥CO2 | |
| D. | 二氧化氯具有强氧化性,可用来漂白织物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
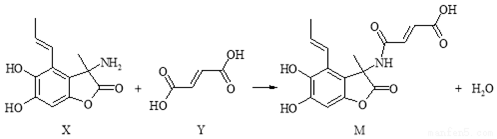
| A. | X分子中有2个手性碳原子 | |
| B. | Y分子中所有原子一定不可能在同一平面内 | |
| C. | 可用FeCl3溶液或NaHCO3溶液鉴别X和Y | |
| D. | 在NaOH溶液中,1 mol M最多可与5 mol NaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com