
| A. | 第一电离能:Al<Mg | B. | 共价键极性:H-F<H-Cl | ||
| C. | 硬度:Al2O3<NaCl | D. | 酸性:H2SO4>H2SO3 |
分析 A.Mg的3s电子全满,为稳定结构;
B.非金属性越强,键的极性越强;
C.离子的电荷越大,半径越小,则晶格能越大;
D.非羟基氧原子个数越多,酸性越强.
解答 解:A.Mg的3s电子全满,为稳定结构,Mg难失去1个电子,则第一电离能:Al<Mg,故A正确;
B.非金属性F>Cl,则共价键极性:H-F>H-Cl,故B错误;
C.离子的电荷越大,半径越小,则晶格能越大,则硬度:Al2O3>NaCl,故C错误;
D.非羟基氧原子个数越多,酸性越强,硫酸、亚硫酸均为二元酸,非羟基氧原子数分别为2、1,则硫酸酸性强,故D正确;
故选AD.
点评 本题考查元素周期表和元素周期律的应用,为高频考点,涉及第一电离能、晶格能判断及酸性比较、极性比较等,注意结构与性质的关系是解答本题的关键,侧重选修三知识点的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | D极电极反应:O2+4e-+4H+=2H2O | B. | E处通入H2,C处有O2放出 | ||
| C. | 甲池中阴极区只有苯被还原 | D. | 导线中共传导14mol电子 |
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三上学期第三次月考模拟化学试卷 题型:选择题
已知:Fe(OH)3和Al(OH)3沉淀的生成与溶解的量如下表。
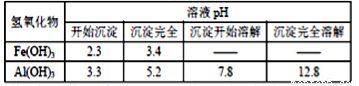
向FeCl3、Al2(SO4)3的混合溶液中逐有加入Ba(OH)2溶液,形成沉淀的情况如下图所示.以下推断错误的是
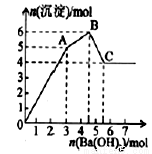
A.AB段可能发生的反应:2Ba2++3OH-+2SO42-+Al3+=2BaSO4↓+Al(OH)3↓
B.C点对应的沉淀:Fe(OH)3和BaSO4
C.OA段可能发生的反应:3Ba2++6OH-+3SO42-+Al3++Fe3+=3BaSO4↓+Fe(OH)3↓+Al(OH)3↓
D.据图计算原溶液中:c(Cl-)=c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最稳定的共价键是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根据表中数据能计算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CHCH(CH3)CH2CH2CH2CH3 | B. | CH2=CHC(CH3)=CHCH2CH3 | ||
| C. | CH2=CHCH(CH3)C≡CH | D. | CH3CH2CH2CH2C(CH3)=CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
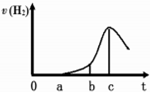 某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.
某兴趣小组进行“活泼金属与酸反应”的实验.将5.4g的铝片投入500mL0.5mol•L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com