
【题目】化学上常用AG 表示溶液中的酸碱度,AG=lg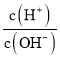 。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
。25℃时,用0.100mol·L-1的NaOH 溶液滴定20.00mL 0.100mol·L-1HNO2溶液,AG与所加NaOH 溶液的体积(V)关系如图所示,下列说法正确的是( )
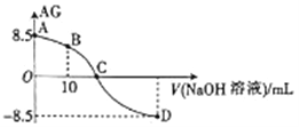
A. B点溶液中存在c(H+)-c(OH-)=c(NO2-)-c(HNO2)
B. D点溶液中的pH=11.25
C. C点时,加入NaOH 溶液的体积为20.00 mL
D. 25 ℃时,HNO2 的电离平衡常数Ka=1.0×10-5.5
【答案】B
【解析】B点是10mL 0.100mol·L-1的NaOH溶液与20.00mL0.100mol·L-1HNO2溶液混合,溶质为等浓度的NaNO2和HNO2;根据电荷守恒,c(H+)+ c(Na+)= c(NO2-)+ c(OH-),根据物料守恒,2c(Na+)= c(NO2-)+c(HNO2),所以2c(H+)-2c(OH-)=c(NO2-)-c(HNO2),故A错误;D点溶液的AG=-8.5,说明中 =10-8.5,所以c(H+)=10-11.25,pH=11.25,故B正确;A点溶液AG=8.5,说明中
=10-8.5,所以c(H+)=10-11.25,pH=11.25,故B正确;A点溶液AG=8.5,说明中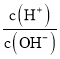 =108.5, c(H+)=10-2.75,pH=2.75,所以HNO2是弱酸,C点AG=0,溶液呈中性,所以加入NaOH溶液的体积小于20.00mL,故C错误; 根据C选项,0.100mol·L-1HNO2溶液c(H+)=10-2.75, 25℃时,HNO2的电离平衡常数Ka=
=108.5, c(H+)=10-2.75,pH=2.75,所以HNO2是弱酸,C点AG=0,溶液呈中性,所以加入NaOH溶液的体积小于20.00mL,故C错误; 根据C选项,0.100mol·L-1HNO2溶液c(H+)=10-2.75, 25℃时,HNO2的电离平衡常数Ka=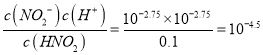 ,故D错误。
,故D错误。


科目:高中化学 来源: 题型:
【题目】有一种新型的乙醇电池,它用磺酸类质子溶剂,在200 ℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为C2H5OH+3O2===2CO2+3H2O,电池示意如图,下列说法不正确的是( )

A. a极为电池的负极
B. 电池工作时,电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为4H++O2+4e-===2H2O
D. 电池工作时,1 mol乙醇被氧化时就有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A![]() B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
B+D在三种不同条件下进行,B、D的起始浓度为0,反应物A的浓度(mol·L-1)随反应时间(min)的变化情况如下表。
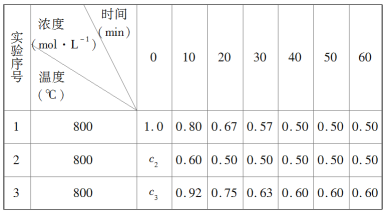
根据上述数据,完成下列填空:
(1)实验1中,10~20 min内A的反应速率为________mol·L-1·min-1。
(2)实验2中,c2=________,反应经20 min时达到平衡,可推测实验2中还隐含的条件是________________________________。
(3)设10~20 min内实验3中A的反应速率为v3,实验1中A的反应速率为v1,则v3________v1(填“>”“=”或“<”),且c3________1.0(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以利用NO2的平衡气体遇热颜色加深、遇冷颜色变浅来指示放热过程和吸热过程。

①按图所示将实验装置连接好。
②向甲烧杯的水中投入一定量的CaO固体,此烧杯中的NO2平衡混合气体的红棕色变深;向乙烧杯中加入NH4NO3晶体,此时烧杯中NO2平衡混合气体颜色变浅。
回答下列问题:
(1)CaO与水反应的化学方程式为_______________________,该反应为________(填“吸热反应”或“放热反应”),CaO与H2O的总能量________(填“高于”或“低于”)Ca(OH)2的能量。
(2)NH4NO3晶体溶于水后,水的温度________(填“升高”或“降低”)。NH4NO3溶于水________(填“是”或“不是”)吸热反应。
(3)查阅资料知,NO2的平衡气体中存在的可逆反应为2NO2(g)![]() N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,原平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”“减小”或“无变化”)。混合气体的颜色不再改变________(填“能”或“不能”)证明反应已达平衡。
N2O4(g),已知NO2为红棕色,N2O4为无色,结合实验知,当温度升高时,原平衡________(填“未被破坏”或“发生移动”),此时反应速率________(填“增大”“减小”或“无变化”)。混合气体的颜色不再改变________(填“能”或“不能”)证明反应已达平衡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:![]()
![]()
(1)恒温恒容条件下,下列能说明此反应已达平衡的是________。
①![]()
②容器中气体的平均摩尔质量不随时间而变化
③容器中气体的密度不随时间而变化
④容器中气体分子总数不随时间而变化
(2)下列有关该反应速率的叙述中,正确的是_________。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(3)下图表示将![]() 和
和![]() 置于2L密闭容器中,当其他条件一定时,
置于2L密闭容器中,当其他条件一定时, ![]() 的平衡转化率a随X的变化关系,
的平衡转化率a随X的变化关系, ![]() 代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。
代表压强或温度。X代表的物理量是___________。A对应条件下平衡常数K=___________。

(4)一定温度下,在容积不变的密闭容器中充入![]() 和
和![]() ,达平衡时
,达平衡时![]() 的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后
的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后![]() 的体积分数仍为a%的是__________。
的体积分数仍为a%的是__________。
a. ![]() b.
b. ![]()
c. ![]() d.
d. ![]()
(5)![]() 与
与![]() 反应生成
反应生成![]() ,
, ![]() 电离方程式为___________,向
电离方程式为___________,向![]() 溶液中加入
溶液中加入![]() 固体,则电离平衡往__________反应方向移动。
固体,则电离平衡往__________反应方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物中,既不能与NaOH溶液发生反应,又不能与溴的CCl4溶液反应,也不能使酸性KMnO4溶液褪色的是( )
A.丙烷B.乙醇C.盐酸D.乙烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com