
分析 (1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反应中氢元素化合价升高失电子做还原剂,氯元素化合价降低得到电子做氧化剂,电子转移总数2e-;
(2)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂;
(3)2KMnO4═K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,转移电子是4mol,氧化还原反应中元素化合价升高的物质失电子最还原剂,元素化合价降低得到电子做氧化剂.
解答 解:(1)H2+Cl2 $\frac{\underline{\;光照\;}}{\;}$2HCl,反应中氢元素化合价0价变化为+1价,氢气做还原剂,氯元素化合价0价变化为-1价,氯气做氧化剂,电子转移总数2e-,电子转移的方向和数目为: ,故答案为:
,故答案为: ;Cl2;H2;
;Cl2;H2;
(2)在反应Zn+H2SO4═ZnSO4+H2↑中,Zn元素的化合价由0升高到+2价,则Zn为还原剂,H元素的化合价由+1降低到0价,则H2SO4为氧化剂,
该反应中转移的电子数为2e-,电子转移的方向和数目为 ,故答案为:
,故答案为: ;H2SO4;Zn;
;H2SO4;Zn;
(3)2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑中Mn的化合价降低,O的化合价升高,所以KMnO4是氧化剂,KMnO4是还原剂,K2MnO4、MnO2是还原产物,O2是氧化产物,转移电子是4mol,电子转移情况如下: ;KMnO4是氧化剂,KMnO4是还原剂,
;KMnO4是氧化剂,KMnO4是还原剂,
故答案为: ;KMnO4;KMnO4.
;KMnO4;KMnO4.
点评 本题考查氧化还原反应,为高频考点,侧重于基本概念、电子转移表示方法的考查,难度不大,注意对基础知识的理解掌握.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: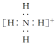 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
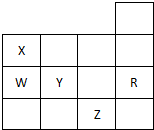
| A. | 常温时五种元素的单质中,Z单质的沸点最高 | |
| B. | Y元素的非金属性比W元素的非金属性强 | |
| C. | Y、Z的阴离子的电子层结构都与R原子的相同 | |
| D. | Y的氢化物的沸点比H2O的沸点高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 手机上用的锂离子电池属于一次电池 | |
| B. | 人们回收废旧电池主要是为了防止重金属对水土的污染 | |
| C. | 氢氧燃料电池的能量转化率可达100% | |
| D. | 太阳能电池的主要材料为二氧化硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室制备1,2一二溴乙烷的反应原理如下:
实验室制备1,2一二溴乙烷的反应原理如下:| 乙醇 | 1.2二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com