
| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
分析 A.铜与氯气反应生成氯化铜;
B.根据标况下的气体摩尔体积计算出混合气体的物质的量结合CO和N2都是双原子分子;
C.浓硫酸与镁反应生成二氧化硫,稀硫酸与镁反应生成氢气;
D.质量转化为物质的量,结合1个-NH2含有9个电子,1个-CH3含有9个电子;
解答 解:A.标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,氯气不足,转移电子数为0.05mol×2=0.1NA,故A错误;
B.标况下,22.4L一氧化碳和二氧化碳的物质的量为1mol,CO和N2都是双原子分子,共含有2NA个原子,故B正确;
C.一定量的浓H2SO4与0.1 mol Mg恰好完全反应,因浓硫酸量不确定,所以生成的二氧化硫分子数可能为0.1mol,也可能小于0.1mol,故C错误;
D.1.6 g-NH2物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有电子数为0.9mol,含有的电子数均0.9NA,1.5 g-CH3物质的量为$\frac{1.5g}{15g/mol}$=0.1mol,含有的电子数均0.9NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
 如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 现象或事实 | 解释 |
| A | 可用铁制容器储存、运输浓硫酸 | 常温下铁与浓硫酸不反应 |
| B | 可用二氧化硫漂白纸浆、草帽等 | 二氧化硫具有氧化性 |
| C | 可用碳酸钠溶液将水垢中的硫酸钙转化为碳酸钙 | Ksp(CaSO4)>Ksp(CaCO3) |
| D | 福尔马林常用来保存新鲜食品 | 福尔马林具有杀菌防腐性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18gH216O和20gH218O含有的质子数均为10NA | |
| B. | 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2═2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
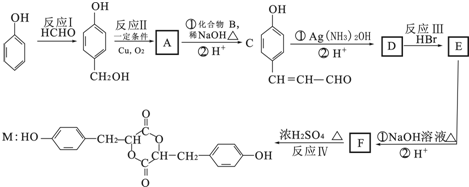
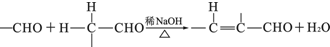
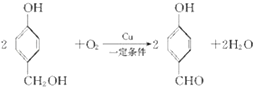 ;
;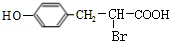 ;
;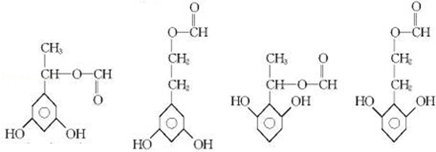 任意2种(任写两种).
任意2种(任写两种).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
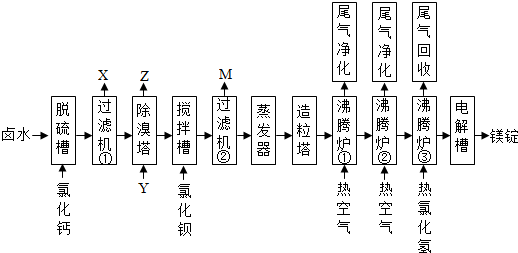
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
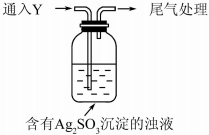 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com