
| A. | 熔融状态下或在水溶液中能自身电离出自由移动的离子的化合物是电解质 | |
| B. | 凡是在水溶液里和熔化状态下都不能导电的物质叫非电解质 | |
| C. | 能导电的物质一定是电解质 | |
| D. | 某物质若不是电解质,就一定是非电解质 |
分析 电解质是指在水溶液或熔化状态下能导电的化合物,而非电解质是指在水溶液和熔化状态下都不能导电的化合物,无论电解质还是非电解质都属于化合物,据此分析判断.
解答 解:A.电解质是在水溶液中或熔融状态下能导电的化合物,故A正确;
B.在水溶液里和熔融状态下都不导电的化合物是非电解质,必须为化合物,所以凡是在水溶液里和熔化状态下都不能导电的物质不一定叫非电解质,故B错误;
C.能导电的物质可能是金属,金属不是化合物,所以不是电解质,故C错误;
D.无论电解质还是非电解质都属于化合物,单质既不是电解质,也不是非电解质,故D错误;
故选A.
点评 本题考查电解质和非电解质,学生应明确电解质和非电解质都是化合物,并明确判断电解质时发生电离的为化合物本身来分析解答即可.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
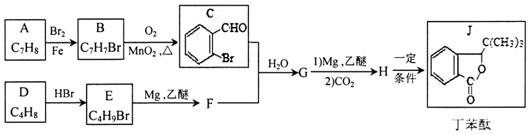
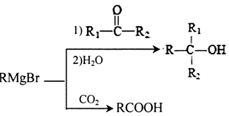
 .H发生缩聚反应生成的高分子化合物的结构简式为
.H发生缩聚反应生成的高分子化合物的结构简式为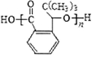 .
.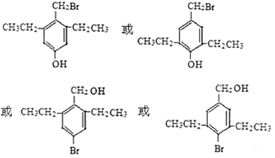 .
.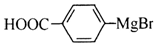 能与CO2反应生成有机物M.符合下列条件的M的同分异构体共有10种.
能与CO2反应生成有机物M.符合下列条件的M的同分异构体共有10种.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的溶液一定显酸性 | |
| B. | 25℃时,0.1mol/L的NaHB溶液呈酸性,说明H2B为强酸 | |
| C. | NH4Cl、CH3COONa、NaHCO3、NaHSO4溶于水,对水的电离都有促进作用 | |
| D. | 0.1mol/L CH3COOH和0.05mol/L NaOH溶液等体积混合,所得溶液中:2c(Na+)═c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 100℃时,纯水中c(H +)=1×10-6 mol•L-1,此时纯水显酸性 | |
| C. | 等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,混合后溶液pH>7 | |
| D. | 1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
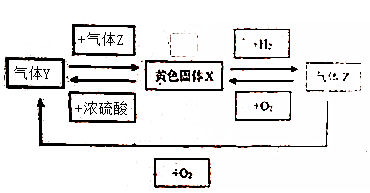
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2的盐酸溶液稀释100倍,pH=0 | |
| B. | pH=12的氢氧化钠溶液稀释10倍,pH=13 | |
| C. | pH=5的硫酸溶液稀释1000倍,pH=8 | |
| D. | pH=3的盐酸溶液稀释10倍,pH=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离的c(H+)=1×10-14mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| D. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com