

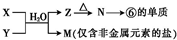
| 加热 |
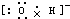 ,
,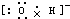 ;
;| 加热 |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| K | Na | KCl | NaCl | |
| 熔点/℃ | 63.6 | 97.8 | 770 | 801 |
| 沸点/℃ | 774 | 882.9 | 1500 | 1413 |
| A、低于770℃ |
| B、约850℃? |
| C、高于882.9℃ |
| D、1413~1500℃? |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若原子X的质子数为a,则X的质量数一定不为a |
| B、若两种元素形成的离子M2-和N+电子层结构相同,则离子半径M2->N+ |
| C、同周期非金属氧化物对应水化物酸性从左到右依次增强 |
| D、由两种元素组成的化合物,若含有离子键,就没有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 一定条件 |

| 交叉偶联 |
查看答案和解析>>
科目:高中化学 来源: 题型:
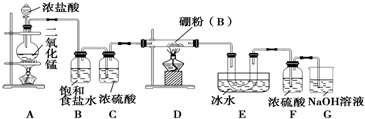
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定存在的离子有CO32-、AlO2-、Na+ |
| B、一定不存在的离子有Ag+、Ba2+、Al3+ |
| C、可能存在的离子是SO42- |
| D、白色沉淀乙只能是BaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、步骤①中的白色沉淀为2种钡盐 |
| B、溶液中难以确定Cl-的存在与否 |
| C、原溶液中所含的离子有5种 |
| D、步骤③中可以确定Fe2+、NO3-的存在,不能确定其它离子是否存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2FeO4在溶液中显强酸性,能消毒杀菌 |
| B、在Na2FeO4中Fe为+6价,具有强氧化性,能消毒杀菌 |
| C、Na2FeO4的还原产物Fe3+易水解为Fe(OH)3胶体,可使水中悬浮物凝聚沉降 |
| D、Na2FeO4的还原产物Fe2+易水解为Fe(OH)2胶体,可使水中悬浮物凝聚沉降 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com