�״���һ�ֿ�����������ȼ�ϣ���;�㷺���о������þ��й���ǰ����
��1����֪�ڳ��³�ѹ�£���÷�Ӧ�ķ�Ӧ�����£�
��2CH
3OH��l��+3O
2��g���T2CO
2��g��+4H
2O��g����H
1=-1275.6kJ/mol
��2CO��g��+O
2��g���T2CO
2��g����H
2=-566.0kJ/mol
CH
3OH����ȫȼ������CO����̬ˮ���Ȼ�ѧ����ʽ��
��
��2����ҵ�������״��ķ�Ӧ���£�CO
2��g��+3H
2��g��?CH
3OH��g��+H
2O��g����H=-49kJ/mol
��ij�¶��£��ݻ���Ϊ1L��A��B���������У�����ͬ��ʽͶ�뷴Ӧ����ֺ��º��ݣ�����B�о�10s��ﵽƽ�⣮�ﵽƽ��ʱ���й��������±���
| ���� |
A |
B |
| ��Ӧ��Ͷ���� |
1mol CO2��g����3mol H2��g�� |
1mol CH3OH��g����1mol H2O��g�� |
| ��Ӧ�����仯 |
�ų���kJ���� |
����19.6kJ���� |
�ٴӷ�Ӧ��ʼ���ﵽƽ��ʱ������B��CH
3OH��ƽ����Ӧ����Ϊ
��
�ڸ��¶��£�B�����з�Ӧ�Ļ�ѧƽ�ⳣ������ֵΪ
��
�ۦ�=
��
�����д�ʩ��ʹ����A�м״��IJ����������
��
a�������¶� b����ˮ��������ϵ����
c���ø���Ч�Ĵ��� d�����������ݻ���Сһ��
��3���ҹ���ѧԺ��ѧ�о����ڼ״�ȼ�ϵ�ؼ�����������ͻ�ƣ���װ�����Ժ�����أ��״�ȼ�ϵ�صĹ���ԭ����ͼ��ʾ��

�ٸõ�ع���ʱ��b��ͨ�������Ϊ
��
�ڸõ�������ĵ缫��ӦʽΪ
��





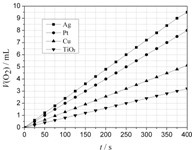 ijЩ�����������������H2O2�ķֽⷴӦ���д����ã���ش��������⣺
ijЩ�����������������H2O2�ķֽⷴӦ���д����ã���ش��������⣺