
【题目】HN3称为叠氮酸,常温下为无色有刺激性气味的液体。![]() 也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成
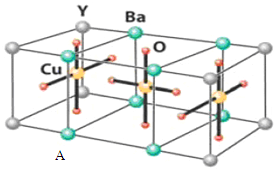
也被称为类卤离子。用酸与叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼金属,如溶解铜生成![]() 。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
。铜和铂的化合物在超导和医药上有重要应用,Cu的化合物A(晶胞如图,图中小黑球代表氧原子,其余大黑球为Y 、Cu 、Ba原子)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2的化合物有两种异构体,其中异构体B可溶水,可用于治疗癌症。试回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为__________________。
(2)元素N、P、S的第一电离能(I1)由大到小的顺序为___________。
(3)HN3属于________晶体,与![]() 互为等电子体的分子的化学式__________(写1种),
互为等电子体的分子的化学式__________(写1种),![]() 的电子式为_________,其中心原子的杂化类型是________________。
的电子式为_________,其中心原子的杂化类型是________________。
(4)![]() 中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
中的键型为__________,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为___。
(5)治癌药物B的结构简式为_______________________。
【答案】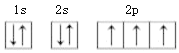 N>P>S 分子 CO2、N2O、COS 、CS2
N>P>S 分子 CO2、N2O、COS 、CS2 ![]() sp3 配位键 7mol
sp3 配位键 7mol 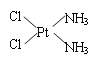
【解析】
(1)氮元素的原子核外有7个电子,轨道表示式为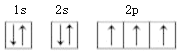 。
。
(2)同一周期,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素大于第VIA族元素,则第一电离能P>S,同一主族,元素的第一电离能随着原子序数的增大而减小,则第一电离能N>P,所以第一电离能大小顺序是:N>P>S。
(3)叠氮酸常温下为无色有刺激性气味的液体,属于分子晶体;![]() 中原子总数为3、价电子总数为16,与
中原子总数为3、价电子总数为16,与![]() 互为等电子体的分子有CO2、N2O、CS2、COS等;
互为等电子体的分子有CO2、N2O、CS2、COS等;![]() 的电子式为
的电子式为![]() ;
;![]() 中N的价层电子对数为4,含有2对孤对电子,所以N为sp3杂化。
中N的价层电子对数为4,含有2对孤对电子,所以N为sp3杂化。
(4)![]() 中Cu+具有空轨道、Cl-具有孤电子对,则Cu+与Cl-间形成配位键;该晶胞中Y原子个数=8×
中Cu+具有空轨道、Cl-具有孤电子对,则Cu+与Cl-间形成配位键;该晶胞中Y原子个数=8×![]() =1,Ba原子个数=8×
=1,Ba原子个数=8×![]() =2,Cu原子个数=3,O原子个数=10×
=2,Cu原子个数=3,O原子个数=10×![]() +2=7,所以该物质的化学式为YBa2Cu3O7,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为7mol。
+2=7,所以该物质的化学式为YBa2Cu3O7,1mol超导氧化物A晶胞中实际占有的氧原子的物质的量为7mol。
(5)化学式为Pt(NH3)2Cl2的化合物有两种异构体,说明Pt(NH3)2Cl2为平面四边形;异构体B可溶水,可用于治疗癌症,根据物质的相似相溶原理,极性溶质极易溶于极性溶剂,水是极性溶剂,所以此种化合物是极性溶质,异构体B的结构可用示意图表示为 。
。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】我国科学家通过测量SiO2中26Al和10Be两种元素的比例来确定“北京人”年龄,这种测量方法叫铝铍测年法。关于26Al和10Be的说法不正确的是
A.10Be和9Be是中子数不同质子数相同的不同原子
B.10Be的原子核内中子数比质子数多
C.5.2 g26Al3+中所含的电子数约为1.2×1024
D.26Al和26Mg的质子数、中子数和核外电子数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
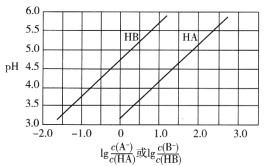
A. Ka(HA)的数量级为10-5
B. 当NaOH溶液与HB混合至中性时:c(B-)<c(HB)
C. 等浓度的NaA、NaB溶液中,水的电离程度:NaA<NaB
D. 等浓度的HB和NaA的混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(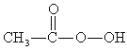 )是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
)是一种高效消毒剂,常用于环境消毒杀菌,可以迅速杀死多种微生物。它可由冰醋酸和过氧化氢在浓硫酸催化作用下制得,实验装置和步骤如下:
①在三颈烧瓶中加入一定量冰醋酸与浓H2SO4的混合液体,再缓缓加入适量30%的双氧水。
②不断搅拌并控制B中混合液的温度为20~30℃至反应结束。
③接入冷凝管和抽气泵,在锥形瓶中收集得到产品。
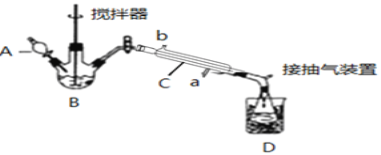
请回答下列问题:
(1)仪器B的名称是__;仪器C中冷水流入口是__(填a或b);
(2)为更好地控制反应温度,应采用方法是__;
(3)生成过氧乙酸的化学方程式为__;
(4)不同反应物比例,实验测得生成过氧乙酸含量(%)随时间的变化数据(见下表),由表中数据可知,反应物最佳比例(CH3COOH/H2O2)是__,反应所需时间约__(选填1、3、5、7)小时;
反应物比例CH3COOH/H2O2 | 反应时间(小时) | ||||
0.5 | 1 | 3 | 5 | 7 | |
2∶1 | 7.38 | 8.46 | 9.42 | 11.26 | 13.48 |
1∶1 | 10.56 | 12.92 | 13.54 | 20.72 | 20.70 |
1∶2 | 6.14 | 7.10 | 7.96 | 10.38 | 12.36 |
(5)请设计实验比较Fe3+、Cu2+对过氧乙酸的催化效率;可供选择的试剂和主要器材有:a.过氧乙酸溶液、b.1mol/L的FeCl3溶液、c.0.5mol/L的Fe2(SO4)3溶液、d.0.5mol/L的CuCl2溶液、e.1mol/L的CuSO4溶液、f.计时器、g.测量气体体积的针筒、i.带导气管的试管。
你选择的试剂及器材是a、__、f
(6)碘量法取2.00mL过氧乙酸试样稀释成100mL,从中取出5.00mL,滴加酸性KMnO4溶液至恰好粉红色以除去残余H2O2,再加入10mL10%KI溶液和几滴淀粉溶液,摇匀,反应完全后再用0.1000mol/L的Na2S2O3标准液滴定至终点(反应方程式为2Na2S2O3+I2=Na2S4O6+2NaI),共消耗14.30mLNa2S2O3标准液。该样品中过氧乙酸的物质的量浓度是__mol/L。(结果保留小数点后两位)
提示:CH3COOOH+2I-+2H+=I2+CH3COOH+H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,在1L密闭容器中加amolSO2和bmolO2发生反应2SO2+O2![]() 2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
2SO3,反应达到平衡时有cmolSO2发生了反应,试填下列空白:
(1)生成___molSO3;
(2)O2的转化率为___;
(3)平衡时容器内气体的总物质的量为___mol;
(4)达到平衡时,c(SO2)=___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 组装该电池应当在无水、无氧的条件下进行
B. 整个过程的能量转化涉及化学能转化为热能和电能
C. 放电时LiV3O8电极反应为:xLi++LiV3O8-xe-=Li1+xV3O8
D. 充电时Cl移向LiV3O8电极
查看答案和解析>>
科目:高中化学 来源: 题型:
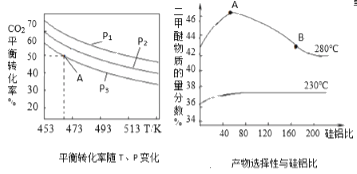
【题目】二氧化碳的有效回收利用,既能缓解能源危机,又可减少温室效应的影响,具有解决能源问题及环保问题的双重意义。Zn/ZnO热化学循环还原CO2制CO的原理如图所示,回答下列问题:
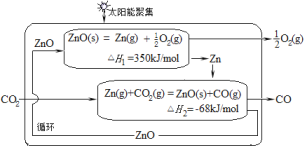
(1)①Zn/ZnO在反应中循环使用,其作用是___。
(2)二甲醚是主要的有机物中间体,在一定条件下利用CO2与H2可直接合成二甲醚:2CO2(g) +6H2(g)![]() CH3OCH3(g)+3H2O(g),
CH3OCH3(g)+3H2O(g),![]() =3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
=3时,实验测得CO2的平衡转化率随温度及压强变化如图所示。
合成二甲醚过程中往往会生成一氧化碳,合成时选用硅铝化合物做催化剂,硅铝比不同时,生成二甲醚或一氧化碳的物质的量分数不同。硅铝比与产物选择性如图所示。图中A点和B点的化学平衡常数比较:KA___KB(填“>、<、=”)。根据以上两条曲线,写出其中一条变化规律:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白色固体混合物A,含有KCl、CaCO3、Na2CO3、Na2SiO3、CuSO4中的几种,常温常压下进行如下实验。
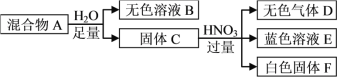
下列推断不正确的是
A. 无色溶液B的pH≥7
B. 白色固体F的主要成分是H2SiO3
C. 混合物A中有Na2SiO3、CuSO4和CaCO3
D. 在无色溶液B中加HNO3酸化,无沉淀;再滴加AgNO3,若有白色沉淀生成,说明混合物A中有KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如图所示,关于该电池的说法不正确的是
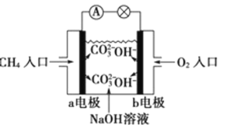
A.应该甲烷燃料电池的总反应:CH4+2O2=CO2+2H2O
B.正极的电极反应是:O2+2H2O+4e-=4OH-
C.a极是负极,发生氧化反应
D.甲烷燃料电池是环保电池
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com