
| 3.9g |
| 78g/mol |
| 3.9g |
| 78g/mol |
| 0.05mol×22.4L |
| 2mol |
| 0.05mol×36g |
| 2mol |
| 0.05mol×4mol |
| 2mol |
| 0.1mol |
| 1L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:



| ||


| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
| O | 2- 3 |
| O | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100mL | B、150mL | C、200mL | D、250mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2CO3+X,X的电子式是______.
Na2CO3+X,X的电子式是______.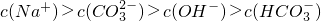
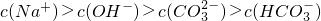
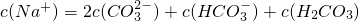

查看答案和解析>>
科目:高中化学 来源: 题型:
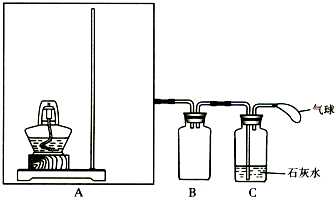
(6分)利用右图所示装置制备氧气并进行相关实验探究。
 (1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。
(1)将3.9g过氧化钠放入烧瓶中,加入100mLH2O,用排水法收集气体,过氧化钠与水反应的化学方程式是 。
(2)已知:酚酞在c(OH-) 为1.0×10-4mol/L~2.5mol/L时呈红色,且半分钟内不褪色;H2O2具有氧化性和漂白性,在MnO2催化条件下迅速分解。取上述实验得到的溶液于试管中,滴入2滴酚酞试液,溶液变红色,片刻红色褪去。(假设过程中液体体积不变)
①甲同学认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的。请通过计算对比数据加以说明上述观点是否正确。 。
②乙同学认为“红色迅速褪去”是由于溶液中存在H2O2,其来源可能是Na2O2+2H2O=2NaOH+H2O2。试设计简单实验证明烧瓶内溶液中含H2O2,简述实验原理 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com