
��9�֣���NH4Cl��Һ��������Ƴ�pH = 4����Һ��Ȼ����е�⣬�����Ƴ���һ�ֳ����Ķ�Ԫ������A���ÿ������������������ۼ��õ���Ϊ������A��A��һ�ֻӷ��Ե��ױ�ը��Ũ��Һ�壬�е�ֻ��700C����ṹ��NH3���ơ�
2-1 ��ȷ��A��д������A�����ӷ���ʽ��
2-2 �Ƚ�A��NH3�ļ��Դ�С��
2-3 ��A��NaClO2�����ʵ���֮��1��6��ϣ��ɵõ�һ����ɫ������������B�Լ���ʹʪ��ĺ�ɫʯ����ֽ����������C��A������Ч����ͬ������Cl2��2.63������д���䷴Ӧ�����ӷ���ʽ��
2-4 ��֪A����Ԫ�صĵ縺����ͬ�������һ������ȷ��A����һ��Ԫ�ش���������ɣ���һ��Ԫ�ش����ָ���ɣ�������ʵ�鲽�衣
2-1 A��NCl3��NH4����3Cl����2H����NCl3��3H2����2�֣�
2-2 NCl3�ļ���С��NH3�ļ��ԡ���1�֣�
2-3 NCl3��3H2O��6ClO2����6ClO2��3Cl����3OH����NH3����2�֣�
2-4 ��NCl3ˮ�⡣����ˮ������������HNO2��HCl����N�����ԣ�Cl�Ը��ԣ���������NH3��HOCl����ôN��Cl����������ǡ���෴��ʵ����ʵ�ǣ�NCl3��ˮ�������N2��HCl����������N2ֻ����HOCl����NH3�IJ��HNO2��HCl�䲻���ܲ���N2������A��NԪ�ش����ָ����Cl��Ԫ�ش���������ɡ���4�֣�


 �㽭�¿γ���άĿ�������ʱ��ѵϵ�д�
�㽭�¿γ���άĿ�������ʱ��ѵϵ�д� ��������ϵ�д�
��������ϵ�д� ���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�߿�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
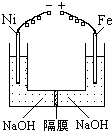 ��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g��
��һ�������������Ժ�CO2������Ӧ��Fe��s��+CO2��g�� FeO��s��+CO��g������H��0
FeO��s��+CO��g������H��0| c(CO) | c(CO2) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
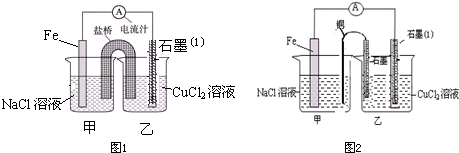 ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽�����
ijʵ��С��ͬѧ�Ե绯ѧԭ��������һϵ��̽������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com