
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(SiHCl3)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产SiHCl3时伴随发生的反应有:
Si(s)+4HCl(g)= SiCl4(g)+2H2(g) H=-241kJ/mol
SiHCl3(g)+HCl(g)=SiCl4(g)+H2(g) H=-31kJ/mol
以硅粉和氯化氢气体生产SiHCl3的热化学方程式是____________________________。
(2)工业上可用四氯化硅和氢化铝锂(LiAlH4)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________。
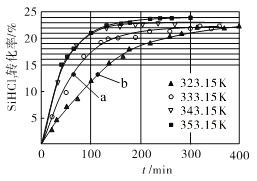
(3)三氯氢硅歧化也可制得甲硅烷。反应2SiHCl3(g) ![]() SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
SiH2Cl2(g)+SiCl4(g)为歧化制甲硅烷过程的关键步骤,此反应采用一定量的PA100催化剂,在不同反应温度下测得SiHCl3的转化率随时间的变化关系如图所示。
①353.15K时,平衡转化率为_________,反应的平衡常数K=________(保留3位小数)。该反应是________反应(填“放热”“吸热”)。
②323.15K时,要缩短反应达到平衡的时间,可采取的措施有_________、__________。
③比较a、b处反应速率的大小:va_____vb (填“>”“<”或“=”)。已知反应速率v正=![]() ,v逆=
,v逆=![]() ,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时
,k1、k2分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在353.15K时![]() =________(保留3位小数)。
=________(保留3位小数)。
【答案】Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol SiCl4+LiAlH4=SiH4+LiCl+AlCl3 24% 0.025 吸热 改进催化剂 增大压强或提高反应物浓度 > 0.025
【解析】
(1)由盖斯定律,①-②得硅粉和氯化氢气体生产SiHCl3的热化学方程式:Si(s)+3HCl(g)=SiHCl3(g)+H2(g) H=-210kJ/mol;
(2)题目信息:四氯化硅和氢化铝锂(LiAlH4)反应后得甲硅烷及两种盐,氢化铝锂中有两种金属元素,刚好成两种盐LiCl、AlCl3 ,方程式为:SiCl4+LiAlH4=SiH4+LiCl+AlCl3;
(3)①由图可知353.15K时,最大转化率24%,则平衡转化率为24%;
反应的平衡常数计算:设起始SiHCl3浓度为1mol/L,根据三段式找到达到平衡各物质浓度,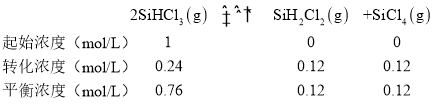
![]() ;
;
由图可知:温度升高,该平衡转化率增大,升温平衡正向移动,则正向是吸热反应。
②323.15K时,要缩短反应达到平衡的时间即加快反应速率,可采取的措施有改进催化剂、增大压强或提高反应物浓度;
③a、b两处转化率相同,说明消耗的SiHCl3等量的,但a的时间比b的短,a的反应速率快,故va>vb;
已知反应速率v正=![]() ,v逆=
,v逆=![]() ,达到平衡时v正=v逆,即
,达到平衡时v正=v逆,即![]() =
=![]() ,变形得
,变形得![]() =
= ,由图可知353.15K时,平衡转化率为24%,则在353.15K时
,由图可知353.15K时,平衡转化率为24%,则在353.15K时![]() =K=0.025。
=K=0.025。


科目:高中化学 来源: 题型:
【题目】(1)写出下列物质的化学式:
胆矾_____________________ 铁红_____________________
苏打_____________________ 明矾__________________
(2)把SO2气体通入品红溶液中,现象为_____,将该溶液加热后,现象为________。把Cl2通入紫色石蕊试液中,现象为_____,将SO2通入紫色石蕊试液中,现象为______。
(3)工业上将氯气通入冷的消石灰[Ca(OH)2]中即制得漂白粉.写出该反应的化学方程式_____,在该反应中,氧化产物是_____(用化学式表示)。
(4)碳酸氢钠可用作治疗胃酸(主要含盐酸)过多的药剂,写出该反应的离子方程式________
(5)常用来作为潜水艇和呼吸面具中氧气来源的是_____________,它的颜色为______;
(6)在试管里放入一块铜片,注入一定体积的浓硫酸 ,给试管加热,使之反应。若铜片还有剩余,硫酸_______消耗完毕(填“已”或“没有”),其理由是_____________;继续向上述溶液中加入下列________物质,铜片会继续溶解。
A.KNO3 B.FeCl3 C.盐酸 D.氢氧化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液时需加入少量铁屑,其目的是__。
(2)甲组同学取2mLFeSO4溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeSO4溶液与氯水反应的离子方程式为___。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__。
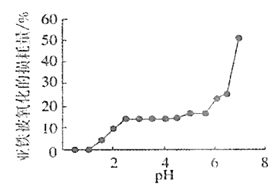
(4)丙组同学研究pH对FeSO4稳定性的影响,得到如图所示结果,增强Fe2+稳定性的措施为__。(写出一条即可)
(5)丁组同学为了探究Fe2(SO4)3与Cu的反应,做了如图所示实验:

①Fe3+与Cu反应的离子方程式为__。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
i.CuSCN是难溶于水的白色固体;
ii.SCN的化学性质与I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填写实验方案:
实验方案 | 现象 |
步骤1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 无明显现象 |
步骤2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 产生白色沉淀 |
Cu2+与SCN-反应的离子方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx会造成大气污染,在工业上采用多种方法进行处理。
I.氧化法:烟气中的NO经O3预处理后转化为NO2,再用CaSO3悬浊液吸收NO2。
已知:常温下,CaSO4的沉淀溶解平衡常数数值为9.1×10-6,CaSO3的沉淀溶解平衡常数数值为3.1×10-7。
(1)NO与O3反应过程的能量变化如下:

NO被O3氧化的总反应是化合反应,该反应的热化学方程式为 ________。
(2)将CaSO3悬浊液静置,取上层清液,测得pH约为8,用化学用语解释其原因为________。
(3)用CaSO3悬浊液吸收NO2,将其转化为HNO2,该反应的化学方程式为________。
(4)在实际吸收NO2的过程中,通过向CaSO3悬浊液中加入Na2SO4固体,提高NO2的吸收速率,从溶解平衡的角度解释其原因:________。
II. 选择性非催化还原法:该反应不使用催化剂,但必须在高温有氧下利用NH3做还原剂与 NOx 进行选择性反应:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
3N2 + 6H2O,不同温度(T)下,反应时间(t)与NO浓度的关系如右图所示。
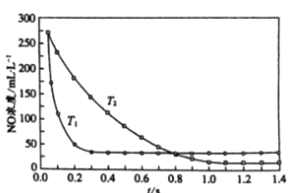
(5)判断该反应为________(填“吸热”或“放热”)反应,说明理由:________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的消毒剂酒精、含氯消毒剂、过氧乙酸等均可有效灭活病毒。病毒对紫外线和热敏感。下列有关说法正确的是
A.84消毒液的主要有效成分是![]()
B.过氧乙酸![]() 可作为消毒剂,与苯酚混合使用杀菌能力更强
可作为消毒剂,与苯酚混合使用杀菌能力更强
C.加热能杀死病毒是因为蛋白质受热变性
D.聚丙烯树脂是生产无纺布口罩的初始原料之一,聚丙烯可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(s)+Y(g) W(g)+Z(g)△H>0,在一定体积不变的容器中反应达到平衡后,改变条件,反应速率(υ)随时间变化的情况如图所示。下列条件的改变与图中情况相符的是 ( )

A.增加了X的物质的量B.降低了温度
C.增大了压强D.增大了Y的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是( )
A.分离、提纯![]() 确定化学式
确定化学式![]() 确定最简式
确定最简式![]() 确定结构式
确定结构式
B.分离、提纯![]() 确定最简式
确定最简式![]() 确定化学式
确定化学式![]() 确定结构式
确定结构式
C.分离、提纯![]() 确定结构式
确定结构式![]() 确定最简式
确定最简式![]() 确定化学式
确定化学式
D.确定化学式![]() 确定最简式
确定最简式![]() 确定结构式
确定结构式![]() 分离、提纯
分离、提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴旋转,某烃结构简式可表示为CH3![]()
![]() ,下列说法中正确的是( )
,下列说法中正确的是( )
A.分子中最多有22个原子处于同一平面上
B.该烃苯环上的一氯代物只有一种
C.分子中至少有10个碳原子处于同一平面上
D.该烃是苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 四种元素,原子序数依次增大,A 原子的最外层上有4个电子;B 的阴离子和 C 的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体 E,D 的 L 层电子数等于 K、M 两个电子层上的电子数之和。
(1)C 离子的结构示意图为_______ 。D 在周期表中位置 ______________。
(2)写出 E 的电子式:______________ 。
(3)A、D 两元素形成的化合物属 ______________(填“离子”或“共价”)化合物。
(4)写出 D 的最高价氧化物的水化物和 A 单质反应的化学方程式:_______ 。
(5)B 原子与氢原子形成的粒子中,与 NH3 具有相同电子数的阴离子为______________(填化学式),这种阴离子的电子式为______________ 。
(6)A、D 两元素形成的某化合物具有与 CO2 相似的结构,试用电子式表示其形成过程__________________________________________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com