
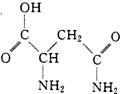
 芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.
芦笋中的天冬酰胺(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效.| 编号 | I5/kJ•mol-1 | I6/kJ•mol-1 | I7/kJ•mol-1 | I8/kJ•mol-1 |
| A | 6990 | 9220 | 11500 | 18700 |
| B | 6702 | 8745 | 15455 | 17820 |
| C | 5257 | 6641 | 12125 | 13860 |
分析 (1)根据天冬酰胺结构可判断所含元素为C、H、N、O,根据价电子排布式可知未成对电子的多少;
(2)从结构中看碳原子形成的化学键的类型,根据碳原子中单键以SP3杂化,双键以SP2杂化,三键以SP杂化判断;
(3)从所给晶体的性质来判断晶体类型体,根据元素的原子的种类判断化学键的类型;
(4)根据金属性和电离能的关系及同族性质的相似性判断元素,写价电子排布式.
解答 解:(1)根据天冬酰胺结构可判断所含元素为C、H、N、O,价电子排布式分别为:2s22p2、1s1、2s22p3、2s22p4,未成对电子分别为:2、1、3、2,故氮元素未成对电子最多,
故答案为:氮;
(2)从结构中看碳原子形成的化学键的类型有单键和双键,碳原子中碳以SP3和SP2杂化,
故答案为:SP3;SP2;
(3)从表中数据看,H2Se沸点很低,故为分子晶体;H2Se中H和Se是不同的非金属原子,故形成的为极性共价键,
故答案为:分子晶体;极性共价键;
(4)钼和铬在同一副族,性质存在相似性和递变性,故电离能也存在相似性,B、C电离能变化相似,且铬的金属性小于钼,故铬的电离能比钼的相应要大,故B为铬,C为钼,A代表锰元素,元素符号为:Mn,Cr元素为24号元素,原子核外有24个电子,所以核外电子排布式为:1s22s22p63s23p63d54s1,铬的价电子排布为:3d54s1,
故答案为:Mn;3d54s1.
点评 本题考查了价电子排布,分子的构型、化学键的类型、晶体类型等知识,题目中等难度.注意铬的价电子排布式半充满状态较稳定.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:实验题
 某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.2000mol•L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 21.30 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.32 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:
氨气是化学实验室常需制取的气体.实验室制取氨气通常有两种方法:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于冰中的水分子间存在氢键,所以其密度大于液态水 | |
| B. | 可以用氢键解释接近沸点的水蒸气的相对分子质量测定值比用化学式(H2O)计算出来的相对分子质量大 | |
| C. | 分子间氢键和分子内氢键都会使熔沸点升高 | |
| D. | 每一个水分子内平均含有两个氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol/L 的Na2CO3溶液中,含有的Na+离子数为2 NA | |
| B. | 0.5 mol H2SO4含有的原子数目为3.5NA | |
| C. | 32 g O2所含的分子数目为NA | |
| D. | 27g金属铝变成铝离子时失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
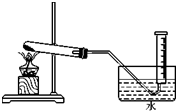 为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:
为验证MnO2在KClO3受热分解制02的反应前后质量不变,某兴趣小组利用如图所示装置进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 指示剂 | 变色范围 | 酸色 | 碱色 |
| 石蕊 | 5.0-8.0 | 红色 | 蓝色 |
| 酚酞 | 8.0-10.0 | 无色 | 红色 |
| 甲基橙 | 3.1-4.4 | 红色 | 黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该烃分子中至少有5个碳原子处于同一直线上 | |
| B. | 该烃分子中所有碳原子可以处于同一平面上 | |
| C. | 该烃分子中至少有12个碳原子处于同一平面上 | |
| D. | 1 mol该烃能与8 mol氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com