
| A. | 只有③ | B. | ③④⑤ | C. | ②④⑤⑥ | D. | ③④⑤⑥ |
分析 ①同周期元素随原子序数的增大,原子半径减小,具有相同电子排布的离子,原子序数的大的,半径小,阴离子的半径大于原子的半径,主族的元素电子层多的半径大;
②非金属性越强,气态氢化物的稳定性越强;
③金属性越强,对应金属的还原性越强;
④非金属性越强,对应单质的氧化性越强;
⑤非金属性越强,对应最高价氧化物的水化物的酸性越强;
⑥同主族元素,电子层数越多,非金属性越弱.
解答 解:①同周期元素随原子序数的增大,原子半径减小,则S>Cl,阴离子的半径大于原子的半径,S2->S,相同电子排布的离子原子序数大的离子半径小,所以S2->Cl-,则微粒半径:S2->Cl->S>Cl,故①正确;
②非金属性F>Cl>S>P,气态氢化物的稳定性为HF>HCl>H2S>PH3,故②正确;
③金属性为K>Na>Mg>Al则金属的还原性K>Na>Mg>Al,故③错误;
④非金属性F>O>Cl>S,则氧化性:F2>O2>Cl2>S,故④错误;
⑤非金属性Cl>S>P>Si,酸性为HClO4>H2SO4>H3PO4>H2SiO3,故⑤错误;
⑥位于同主族,非金属性F>Cl>Br>I,则得电子能力F>Cl>Br>I,故⑥正确;
故选B.
点评 本题考查元素周期表和元素周期律,为高频考点,把握元素的位置、同周期和同主族元素性质变化规律为解答的关键,注意理解元素周期律,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
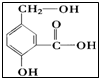 按要求回答下列各题.
按要求回答下列各题. 的名称为2,2,4,5-四甲基-3,3-二乙基庚烷.
的名称为2,2,4,5-四甲基-3,3-二乙基庚烷. .
.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子的最外层电子数等于主族族序数 | |
| B. | 元素的最高价等于原子最外层电子数 | |
| C. | 最低负价数的绝对值等于原子最外层变稳定结构时所需电子数 | |
| D. | 同周期元素原子具有相同的核外电子层数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.
原电池是一种将化学能转化为电能的装置.在Cu-Zn原电池中,Zn极是电池的负极(填“正极”或“负极”)发生氧化反应(填“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com