
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) | 溶解性 |
| 甲 | -68 | 115 | 0.93 | 易溶于水 |
| 乙 | -84 | 77 | 0.90 | 易溶于甲 |
| A. | 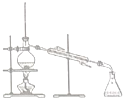 | B. | 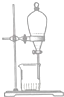 | C. | 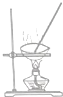 | D. | 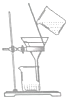 |
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、Na+、SO42- | B. | Na+、H+、OH-、Cl- | ||
| C. | Mg2+、K+、Cl-、NO3- | D. | Ca2+、K+、CO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加稀盐酸产生无色气体,将气体通过澄清石灰水中,溶液变浊,一定有SO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42- | |
| C. | 加氢氧化钠并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ | |
| D. | 某溶液焰色反应为黄色,则待测液中一定不含钾元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 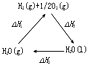 图中△H1=△H2+△H3 | |
| B. | 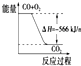 从图可看出CO2的能量高于CO+O2 | |
| C. |  从图可看出反应中加入催化剂可降低反应物能量 | |
| D. | 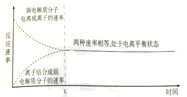 图中t0时间段后(不包含t0)电解质溶液中,弱电解质分子与离子都存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P、Q、R、S的浓度相等 | B. | P、Q、R、S在密闭容器中共存 | ||
| C. | P、Q、R、S的浓度不再变化 | D. | 容器内的压强不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 8种 | C. | 6种 | D. | 4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
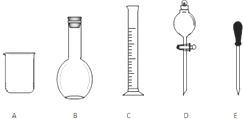 实验室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/L NaOH溶液480mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com