
把煤作为燃料可通过下列两种途径获得热量:
途径I:直接燃烧:C(s)+O2(g) CO2(g) (放热393.5kJ)
CO2(g) (放热393.5kJ)
途径Ⅱ:先制成水煤气,再燃烧水煤气:
C(s)+ H2O(g)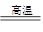 CO(g)+H2(g) (吸热131.5kJ)
CO(g)+H2(g) (吸热131.5kJ)
CO(g)+1/2O2(g) CO2(g), H2(g)+ 1/2O2(g)
CO2(g), H2(g)+ 1/2O2(g) H2O(g) (共放热525kJ)
H2O(g) (共放热525kJ)
试回答下列问题:
(1)判断途径I放出的总热量______(填“大于”、“等于”或“小于”)途径Ⅱ放出的总热量。
(2)在制水煤气的反应里,反应物所具有的总能量______生成物所具有的总能量(填“大于”、“等于”或“小于”),因此在反应时,反应物就需要______能量才能转化为生成物。
(3)途径I中通常将煤块粉碎、经脱硫处理、在适当过量的空气中燃烧,这样处理的目的是 ;
①使煤充分燃烧,提高能量的转化率 ②减少SO2的产生,避免造成“酸雨”
③减少有毒的CO产生,避免污染空气 ④减少CO2的产生,避免“温室效应”
(每空2分,共8分)(1)等于 (2)小于 吸收 (3) ①②③
解析试题分析:(1)根据能量守恒可知,判断途径I放出的总热量等于途径Ⅱ放出的总热量。
(2)在制水煤气的反应里,反应是吸热反应,所以反应物所具有的总能量小于生成物所具有的总能量,因此在反应时,反应物就需要吸收能量才能转化为生成物。
(3)将煤块粉碎,可以增大反应物的接触面积,加快反应速率。经脱硫处理,可以减少SO2的产生,避免造成“酸雨”;在适当过量的空气中燃烧,可以使煤炭充分燃烧,减少有毒的CO产生,避免污染空气,所以答案选①②③。
考点:考查煤综合应用的有关判断
点评:该题是基础性试题的考查,试题贴近生活实际,有利于调动学生的学习兴趣和学习积极性,也有利于培养学生的环境保护意识和能源节约意识。


科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市五校联考高二上学期期中考试化学卷 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
查看答案和解析>>
科目:高中化学 来源:2010年广东省东莞市五校联考高二上学期期中考试化学卷 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101 kPa下测得的热量)。
(1)反应的热化学方程式为 。
(2)又已知H2O(l)=H2O(g) ΔH=+44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 。
(4)盖斯定律在生产和科学研究中有很重要的意义。已知把煤作为燃料可通过下列两种途径:
途径I:C(s) +O2 (g) == CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s) +H2O(g) == CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2 (g) == 2CO2(g) △H3<0 ③
2H2(g)+O2 (g) == 2H2O(g) △H4<0 ④
则△H1、△H2、△H3、△H4的数学关系式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com