
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
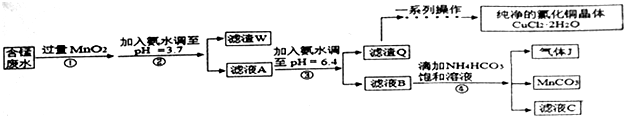
分析 酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)加过量MnO2,将Fe2+氧化为Fe3+,加氨水调节pH,Fe3+转化为Fe(OH)3沉淀,过滤,滤渣为Fe(OH)3和过量的MnO2,滤液A含有Mn2+、Cl-、H+、Cu2+,加氨水调节pH=6.4,则Cu2+转化为Cu(OH)2沉淀,过滤,滤渣为Cu(OH)2沉淀,滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水;
(1)MnO2在酸性条件下可将Fe2+氧化为Fe3+,结合原子守恒和电荷守恒书写;
(2)根据流程分析判断;
(3)调pH=6.4,除去溶液中的铜离子;
(4)滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水;
(5)从溶液中提取溶质,要经过加热浓缩,降温结晶,过滤、洗涤、低温烘干;
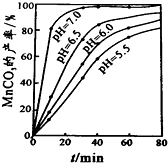
(6)根据沉锰的图象可知,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果;
(7)得到的滤液中还有大量的铵根离子和氯离子没有反应,据此判断副产品.
解答 解:酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)加过量MnO2,将Fe2+氧化为Fe3+,加氨水调节pH,Fe3+转化为Fe(OH)3沉淀,过滤,滤渣为Fe(OH)3和过量的MnO2,滤液A含有Mn2+、Cl-、H+、Cu2+,加氨水调节pH=6.4,则Cu2+转化为Cu(OH)2沉淀,过滤,滤渣为Cu(OH)2沉淀,滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水;
(1)MnO2在酸性条件下可将Fe2+氧化为Fe3+,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
故答案为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(2)根据流程分析可知,所得滤渣W的成分是Fe(OH)3和过量的MnO2;
故答案为:Fe(OH)3和过量的MnO2;
(3)调pH=6.4,除去溶液中的铜离子,使Cu2+ 完全沉淀为Cu(OH)2;
故答案为:使Cu2+ 完全沉淀为Cu(OH)2;
(4)滤液B含有Mn2+、Cl-,加碳酸氢铵反应生成二氧化碳气体、碳酸锰、氯化铵、水,其反应的离子方程式为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
故答案为:Mn2++2HCO3-=MnCO3↓+CO2↑+H2O;
(5)从溶液中提取溶质,要经过加热浓缩,降温结晶,过滤、洗涤、低温烘干;
故答案为:加热浓缩,降温结晶;
(6)从沉锰的图象可以看出,在已给的几个pH值条件下,pH越大得到的MnCO3的产率越高,且需要的时间越短,且在pH=7时,有更好的效果,因此结论是pH等于7.0时反应速率最快,且MnCO3的产率最高,
故答案为:7.0;pH等于7.0时反应速率最快,且MnCO3的产率最高;
(7)得到的滤液中还有大量的铵根离子和氯离子没有反应,因此可以制的副产品为:NH4Cl,
故答案为:NH4Cl.
点评 本题通过碳酸锰的制备,考查了物质制备实验方案的设计方法,题目难度较大,明确制备流程及相应的反应原理为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3 水解生成的Fe(OH)3胶粒数为lNA | |
| B. | 4.6g有机物C2H6O的分子结构中含有的C一H键数目一定为0.5NA | |
| C. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 1 mol/L AlCl3溶液中含有3NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>X,离子半径Z<W | |
| B. | 元素Y的单质能与元素X的最高价氧化物发生置换反应 | |
| C. | 元素Y和W能形成YW2型离子化合物 | |
| D. | W的单质有毒,能使湿润的有色布条褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种含氧官能团 | |
| B. | 可发生取代、加成、消去、加聚等反应 | |
| C. | 该物质的分子式为C10H10O6 | |
| D. | 1mol分枝酸最多可与3molNaOH发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com