
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
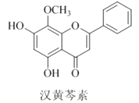
A.汉黄芩素的分子式为C16H13O5
B.该物质中含有四种含氧官能团
C.1mol该物质与溴水反应,最多消耗2molBr2
D.与足量H2发生加成反应后,该分子中官能团的种类减少1种
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列叙述正确的是( )

①a、c两点均可以表示CaSO4溶于水所形成的饱和溶液
②a点对应的Ksp不等于c点对应的Ksp
③b点对应的溶液将有沉淀生成
④d点溶液通过蒸发溶剂可以变到c点
⑤常温下CaSO4溶于水的饱和溶液中,c(Ca2+)与c(SO42-)的乘积对应曲线上任意一点
⑥常温下,向100 mL饱和CaSO4溶液中加入400 mL0.01 mol/L Na2SO4溶液,能使溶液由a点变为b点
A.2句B.3句C.4句D.5句
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年,美国退出了《巴黎协定》实行再工业化战略,而中国却加大了环保力度,生动诠释了我国负责任的大国形象。近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化量产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
H2O(g) +CO(g) ΔH1 = + 41.1 kJmol-1
CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_______。
(2)为提高CH3OH产率,理论上应采用的条件是_______(填字母)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X平衡转化率变化曲线。

① 反应物X是_______(填“CO2”或“H2”)。
② 判断依据是_______。
(4)250℃、在体积为2.0L的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min时反应达到平衡,测得c(CH3OH) = 0.75 mol· L-1。
① 前10min的平均反应速率v(H2)=_______ mol·L-1·min -1。
② 化学平衡常数K = _______。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO纳米棒 | 15.3 | 39.1 |
D | span>553 | Cu/ZnO纳米片 | 12.0 | 70.6 |
根据上表所给数据,用CO2生产甲醇的最优选项为_______(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有浓度均为0.1 mol·L-1的下列溶液:①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 请回答下列问题:
(1)四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)________________________。
(2)将③和④等体积混合后,混合液中各离子浓度由大到小的顺序是__________________________。
(3)已知T ℃,KW=1×10-13,则T ℃________25 ℃(填“>”、“<”或“=”)。在T ℃时将pH=11的NaOH溶液a L与pH=1的硫酸b L混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=10,则a∶b=________。
(4)25 ℃时,有pH=x的盐酸和pH=y的氢氧化钠溶液(x≤6,y≥8),取a L该盐酸与b L该氢氧化钠溶液反应,恰好完全中和,求:
①若x+y=14,则a/b=________(填数据);
②若x+y=13,则a/b=________(填数据);
③若x+y>14,则a/b=________(填表达式);
④该盐酸与该氢氧化钠溶液完全中和,两溶液的pH(x、y)的关系式为________(填表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知Ksp(AgCl)=1.8×10-10,则将AgCl放在蒸馏水中形成饱和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,则将Mg(OH)2放入蒸馏水中形成饱和溶液,溶液的pH为________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,刚好出现沉淀时,溶液的pH是________?当Mg2+完全沉淀时,溶液的pH为________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 除去乙醇中的少量水,方法是加入新制生石灰,经过滤后即得乙醇
B. HOCH2CH(CH3)2与(CH3)3COH属于碳链异构
C. 除去乙酸乙酯中的乙酸和乙醇杂质,可加入足量烧碱溶液,通过分液即得乙酸乙酯
D. 一个苯环上已经连有-CH3、-CH2CH3、-OH三种基团,如果在苯环上再连接一个-CH3,其同分异构体有16种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香豆素是一种用途广泛的香料,可用于配制香精以及制造日用化妆品和香皂等。以有机物M和有机物A合成香豆素的流程如下:

已知以下信息:
①(CH3)3CCHO+CH3CHO
②M的分子式为C2H6O,分子中有3种化学环境不同的氢原子
③香豆素中含有两个六元环
(1)由M生成B的化学方程式为___。
(2)A的结构简式为___。
(3)由E生成香豆素的化学方程式为___。
(4)写出满足如下条件的C的一种同分异构体的结构简式:__。
①能发生银镜反应 ②1molC完全反应能消耗2molNaOH
③苯环上有3个取代基 ④苯环上的一氯代物只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在化工领域有重要的作用:
(1)以铁为催化剂,![]() mol氮气和
mol氮气和![]() mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为
mol氢气在恒温、容积恒定为1L的密闭容器中反应生成氨气,20min后达到平衡,氮气的物质的量为![]() mol。
mol。
①该条件下氮气的转化率是______,该温度下![]() 的化学平衡常数是______
的化学平衡常数是______![]() 保留小数点后两位
保留小数点后两位![]() 。
。
②在第25min时,保持温度不变,将容器体积迅速增大至2L并保持恒容,体系达到平衡时![]() 的总转化率为
的总转化率为![]() 氮气的转化率减小的原因是______。
氮气的转化率减小的原因是______。
③合成氨反应:![]()
![]() ,在反应过程中只改变一个条件,正反应速率的变化如图所示:
,在反应过程中只改变一个条件,正反应速率的变化如图所示:![]() 时改变的条件是______;
时改变的条件是______;![]() 时改变的条件是______。
时改变的条件是______。

(2)①![]() 是一种高能燃料,有强还原性,可通过
是一种高能燃料,有强还原性,可通过![]() 和NaClO反应制得,写出该制备反应的化学方程式______。
和NaClO反应制得,写出该制备反应的化学方程式______。
②N2H4的水溶液呈弱碱性,室温下其电离常数![]() ,则
,则![]()
![]() 水溶液的pH等于______
水溶液的pH等于______![]() 忽略
忽略![]() 的二级电离和
的二级电离和![]() 的电离
的电离![]() 。
。
③已知298K和101kPa条件下:
![]()
![]()
![]()
![]()
则![]() 的燃烧热
的燃烧热![]() ______。
______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是( )
A.向H2S水溶液中加入NaOH有利于S2-增多
B.过氧化氢分解加催化剂二氧化锰,使单位时间内产生的氧气的量增多
C.合成氨时将氨液化分离,可提高原料的利用率
D.新制氯水久置后颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com