
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
分析 (1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动,反应是气体体积不变的吸热反应;
(2)依据热化学方程式和盖斯定律计算分析得到;
(3)①正反应放热,降温时平衡正向移动;
②平衡常数表达式为K=$\frac{生成物平衡浓度的幂次方乘积}{反应物平衡浓度的幂次方乘积}$;
③反应前后气体体积不变,等比例加入反应物,平衡与原平衡等效.
解答 解:(1)达到平衡后,体积不变时,能提高H2O的平衡转化率,应使平衡向正反应方向移动,反应是气体体积不变的吸热反应;
A.反应是吸热反应,升高温度平衡正向进行,反应速率增大,有利于提高H2O的平衡转化率,故A符合;
B.增加碳的用量,固体不改变化学平衡,水的转化率不变,故B不符合;
C.加入催化剂改变化学反应速率,不改变化学平衡,水的转化率不变,故C不符合;
D.用CO吸收剂除去CO,平衡正向进行,水的转化率增大,故D符合;
故答案为:AD;
(2)①C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1,
②C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,
依据热化学方程式和盖斯定律②-①得到,CO(g)+H2O(g)?CO2(g)+H2(g),△H=-41.2kJ•mol-1;
故答案为:-41.2kJ•mol-1 ;
(3)①正反应放热,降温时平衡正向移动,v(正)>v(逆),
故答案为:<;
②CO和H2O反应了0.06mol,则CO2和H2生成了0.06mol,平衡时各物质的浓度为:反应物CO和H2O为0.05mol/L,生成物CO2和H2为0.03mol/L,平衡常数表达式为K=$\frac{生成物平衡浓度的幂次方乘积}{反应物平衡浓度的幂次方乘积}$=$\frac{0.03mol/L×0.03mol/L}{0.05mol/L×0.05mol/L}$=0.36,
故答案为:0.36;
③反应前后气体体积不变,与原平衡等比例加入反应物,平衡与原平衡等效,所以,平衡时各物质的浓度与原判断相同,
故答案为:不变.
点评 本题主要考查了平衡移动、盖斯定律应用、平衡常数的计算、等效平衡,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氮原子的质量就是氮的相对原子质量 | |
| B. | 氢氧化钠的摩尔质量是40 g | |
| C. | 1mol H2SO4中含有1mol H2 | |
| D. | 氩气的摩尔质量在数值上等于它的相对原子质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③④ | C. | ①④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 以NaCl等为原料制备KClO4的过程如下:
以NaCl等为原料制备KClO4的过程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,含有离子键和非极性共价键的化合物的电子式为
,含有离子键和非极性共价键的化合物的电子式为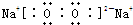 ;含有极性共价键和非极性共价键的化合物的电子式为
;含有极性共价键和非极性共价键的化合物的电子式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
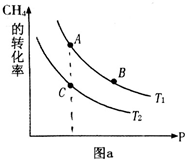 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
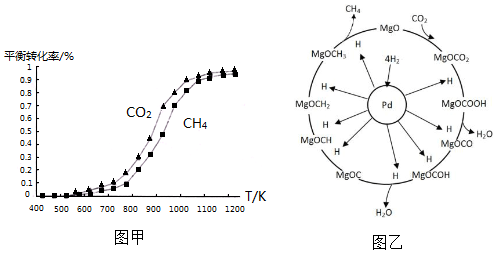 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com