


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.P4和NO2都是共价化合物 |
| B.次氯酸的结构式为H-Cl-O |
| C.在CaO和SiO2晶体中,都不存在单个小分子 |
| D.CCl4和NH4Cl都是以共价键结合的分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.离子晶体的晶格能:Mg0> KCI> NaCl |
| B.“冰,水为之,而寒于水”说明相同质量的水和冰,冰的能量高 |
| C.对于反应2H202=2H20+02↑,加入Mn02或升高温度都能加快02的生成速率 |
| D.对羟基苯甲醛的沸点大于邻羟基苯甲醛,原因是后者分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.“墙内开花,墙外香”——分子在不断地运动 |
| B.湿衣服晾在有太阳的地方比晾在没有太阳的地方容易干——温度高分子的运动速度加快 |
| C.热胀冷缩——分子的大小随着温度的改变而改变 |
| D.水电解生成氢气和氧气——在化学变化中,分子分解成原子,原子又构成新的分子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实 验 事 实 | 理 论 解 释 |
| A. | SO2溶于水形成的溶液能导电 | SO2是电解质 |
| B. | 白磷为正四面体分子 | 白磷分子中P—P间的键角是109°28′ |
| C. | 1体积水可以溶解700体积氨气 | 氨是极性分子且由于有氢键的影响 |
| D. | HF的沸点高于HCl | H—F的键长比H—Cl的键长短 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
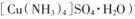 是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下:
是一种重要的染料及农药中间体。某学习小组以孔雀石(主要成分为Cu2(OH)2CO3,含少量Fe2O3和SO2杂质)为原料制备该物质的流程如下: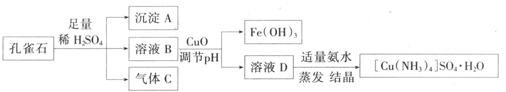
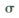 键和
键和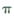 键的个数比为______
键的个数比为______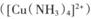 的配位键____________。
的配位键____________。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com