
| A. | ①② | B. | ②③ | C. | ?①③ | D. | ②④ |
分析 ①1mL pH=2的H2SO4溶液加水稀释到100mL,c(H+)由0.01mol/L变为0.0001mol/L;
②NH4Cl浓度越小,NH4+水解程度越大,铵根离子的浓度小;
③碳酸氢钠属于弱酸的酸式盐,既有水解又有电离;
④若溶液中醋酸的浓度远大于醋酸钠的浓度,则c(CH3COOH)>c(Na+)结合电荷守恒分析;
解答 解:①1mL pH=2的强酸溶液加水稀释到100mL,溶液中氢离子浓度c(H+)由0.01mol/L变为0.0001mol/L,则稀释后溶液的pH=-lg0.0001=4,故①正确;
②溶液中弱电解质离子的浓度越小,水解程度越大,2L 0.25mol•L-1NH4Cl溶液与1L 0.50mol•L-1NH4Cl溶液,前者浓度小,水解程度大,所以氯化铵溶液中铵根离子的浓度前者小,故②错误;
③碳酸氢钠溶液中既有碳酸氢根的水解又有碳酸氢根离子的电离,碳酸氢根离子的电离为:HCO3-+H2O?H3O++CO32-,故③正确;
④CH3COOH、CH3COONa等体积混合,溶液呈电中性:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),若溶液中醋酸的浓度远大于醋酸钠的浓度,则c(CH3COOH)>c(Na+),c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+),故④错误;
故选C.
点评 本题考查pH与酸的稀释、盐类水解及溶液的电中性等,注意②水解规律中越稀越水解,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该温度下,0.005mol/L H2A溶液中水电离出的c(H+)=10-12mol/L | |
| B. | H2A在水溶液中的电离方程式为:H2A?H++HA-,HA-?A2-+H+ | |
| C. | (NH4)2A溶液中存在离子浓度关系:(NH4+)>(A2-)>(H+)>(OH-) | |
| D. | 等体积等浓度的盐酸与H2A溶液分别与5.6gFe反应,H2A产生的H2多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ①②⑤ | C. | 只有③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
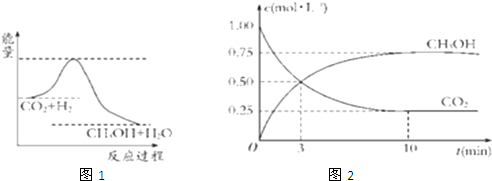
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
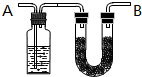 将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108.
将含有C、H、O的有机物3.24g装入元素分析装置,通入足量的O2使之完全燃烧,将生成的气体依次通过管A和管B,测得A管质量增加了2.16g,B管增加了9.24g,已知该有机物的相对分子质量为108. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=NO${\;}_{3}^{-}$+NO↑+H2O | |
| B. | 向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ | |
| C. | 氧化亚铁溶于稀硝酸:FeO+2H+=Fe2++H2O | |
| D. | NH4HSO4溶液中加入等物质的量的Ba(OH)2溶液:NH4++H++SO42一+Ba2++2OH?=NH3•H2O+BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
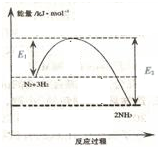 氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.
氨气在农业和国防工业都有很重要的作用,历史上诺贝尔奖曾经有三次颁给研究合成氨的科学家.| 时间/min | 20 | 60 | 40 | 80 |
| n(N2)/mol | 0.016 | 0.032 | 0.040 | 0.040 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com