
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| C. | 常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.8NA | |
| D. | 标准状况下,2.24 L已烷含有分子的数目为0.1NA |
分析 A、次氯酸根为弱酸根,在溶液中会水解;
B、氮气和CO的摩尔质量均为28g/mol,且均为双原子分子;
C、过氧化钠和水的反应中,氧元素由-1价变为0价;
D、标况下己烷为液体.
解答 解:A、次氯酸根为弱酸根,在溶液中会水解,故溶液中的次氯酸根个数小于NA个,故A错误;
B、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,且两者均为双原子分子,故0.5mol混合物中含NA个原子,故B正确;
C、过氧化钠和水的反应中,氧元素由-1价变为0价,故当生成0.2mol氧气时,转移0.4mol电子即0.4NA个,故C错误;
D、标况下己烷为液体,故不能根据气体摩尔体积来计算其物质的量和分子数目,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
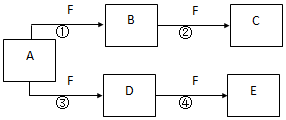 X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题:
X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍.A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,D的钠盐是一种致癌物质,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示.回答下列问题: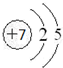 ,A的电子式为
,A的电子式为 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
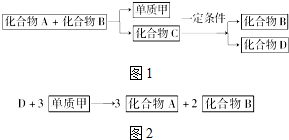 A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:
A、B、C是大家熟悉的与生命活动密切相关的三种化合物,它们所含元素不超过三种,并有如图1所示的转化关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).
.其最高价氧化物对应水化物的碱性比Mg(OH)2强(填“强”或“弱”).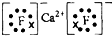 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有H、O、N、Na四种元素:
有H、O、N、Na四种元素: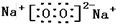 ;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;
;由两种元素组成的既有极性键又有非极性共价键物质的结构式是(写一种)H-O-O-H;查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 操作及现象 | 溶 液 |
| A | 通入CO2,溶液变浑浊.再升温至65℃以上,溶液变澄清 | C6H5ONa溶液 |
| B | 通入CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| C | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| D | 通入CO2,溶液变浑浊,继续通CO2至过量,浑浊消失.再加热溶液,又变浑浊 | CaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某无色晶体加入氢氧化钠浓溶液中并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该晶体中一定有NH4+ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com