
| A. | C2H5Br | B. | 氯水 | C. | 溴的CCl4溶液 | D. | KClO3溶液 |
分析 加入少量的AgNO3溶液能得到沉淀说明溶液中有卤离子,凡是有卤离子都符合题意.
解答 解:A.C2H5Br是电解质,不溶液水,不能电离出溴离子,所以不能和硝酸银反应生成沉淀,故A错误;
B.氯水中含有氯离子,加入少量硝酸酸化的AgNO3溶液,氯离子与银离子反应生成氯化银沉淀,故B正确;
C.溴易溶于四氯化碳,加入硝酸银,溶液分层,溴在四氯化碳层,不能与硝酸银溶液反应,得不到沉淀,故C错误;
D.氯酸钾电离生成钾离子与氯酸根离子,与硝酸银不反应,不会生成沉淀,故D错误;
故选:B.
点评 本题考查了卤离子的检验,解题时应注意有机物中含有卤原子但是非电解质不能电离产生卤离子,题目难度不大.


科目:高中化学 来源: 题型:选择题
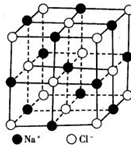
| A. | NaC1晶体中Na+与C1-的个数比为1:1 | |
| B. | 每个Na+周围距离最近的C1-数为6 | |
| C. | 和Na+距离相等且最近的C1-构成的多面体是正八面体 | |
| D. | 每个Na+周围距离最近的Na+数为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:
元素X基态原子核外电子数为29,元素Y位于X的前一周期且最外层电子数为1,元素Z基态原子3p轨道上有4个电子,元素P原子最外层电子数是其内层电子数的3倍,元素Q基态原子2p半充满.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
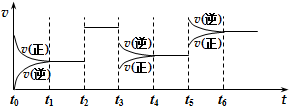 某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )
某密闭容器中发生如下反应:2X(g)+Y(g)?Z(g)△H<0.下图是表示该反应速率(v)随时间(t)变化的关系图.t2、t3、t5时刻外界条件均有改变(但都没有改变各物质的用量).则下列说法中不正确的是( )| A. | t3时减小了压强 | |
| B. | t5时增大了压强 | |
| C. | t6时刻后反应物的转化率最低 | |
| D. | t1时该反应的平衡常数大于 t6时反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
 .B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;
.B的氧化物溶于氢氧化钠溶液的方程式为Al2O3+2NaOH+3=2NaAlO2+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
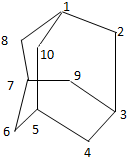 有的油田开采的石油中溶有一种碳氢化合物-金刚烷.
有的油田开采的石油中溶有一种碳氢化合物-金刚烷.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
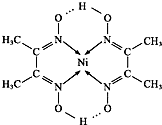
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com