
原子序数依次增大的元素a、b、c、d,它们的最外层电子数分别为1、6、7、1。a-的电子层结构与氦相同,b和c的次外层有8个电子,c-和d+的电子层结构相同。下列叙述错误的是
A.元素的非金属性次序为c>b>a
B.a和其他3种元素均能形成共价化合物
C.d和其他3种元素均能形成离子化合物
D.元素a 、b、c各自最高和最低化合价的代数和分别为0、4、6
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某金属氧化物在光照下可生成具有很强氧化能力的物质,能用来消除空气或水体中的污染物。下列有关该金属氧化物应用的叙述不正确的是( )。
A.将形成酸雨的SO2氧化为SO3
B.将家居装修挥发出的甲醛氧化为CO2和H2O
C.将医药废水中的苯酚氧化成H2O和CO2
D.将电镀废水中的氰根离子CN-氧化成CO2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
现有一份NaOH固体样品,里面混有少量的Na2CO3、NaCl杂质,某同学用中和滴定的方法来测定NaOH的纯度。其操作如下:
①称取a g样品放入锥形瓶中,加水,振荡,使固体充分溶解。
②向该溶液中加入足量的BaCl2溶液,使CO 沉淀完全。
沉淀完全。
③向所得混合液中滴入2~3滴酚酞指示剂,然后用c mol·L-1的盐酸进行滴定。
④当反应达终点时,测得消耗盐酸的体积为V mL。
⑤计算样品的纯度。
试回答下面的问题
(1)滴定终点时溶液颜色如何变化:__________________________________________。
(2)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,是否会对NaoH的含量测定造成影响(填“是”或“否”)______,理由是___________________________________。
(3)第②步中生成的BaCO3沉淀未过滤出来就直接用盐酸滴定,能否改用甲基橙作指示剂(填“是”或“否”)______,理由是________________________________________。
(4)根据上述实验数据,列出计算NaOH纯度的表达式
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是
A.KOH中含有离子键也含有共价键,属于离子化合物
B.HCl中存在离子键,属于离子化合物
C.含有共价键的化合物一定是共价化合物
D.阴、阳离子间通过静电引力而形成的化学键叫做离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积不变的密闭容器中发生反应2NO2 (g)  2NO(g)+O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+O2(g),能说明该反应已达化学平衡状态的是
①生成n mol O2的同时生成2n mol NO2 ②生成n mol O2的同时生成2n mol NO
③v(NO2)∶v(NO)∶v(O2)=2∶2∶1 ④混合气体的颜色不再改变
⑤混合气体的密度不再改变 ⑥混合气体的平均相对分子质量不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. ④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g)  2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0, 一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.反应前2min的平均速率ν(Z)=2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C.该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
I.在500 ℃、2×107 Pa和催化剂条件下合成氨工业的核心反应是:N2(g)+3H2(g) 2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
2NH3(g) ΔH=Q kJ·mol-1。反应过程中能量变化如图所示,回答下列问题:
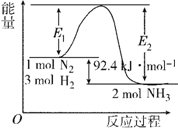
(1) 在500 ℃、2×107Pa和催化剂条件下向一密闭容器中充入0.5 mol N2和1.5 mol H2,充分反应后,放出的热量_____(填“<”“>”或“=”)46.2 kJ,理由是_____________________。
(2) 将一定量的H2(g)和N2(g)放入1 L密闭容器中,在500 ℃、2×107 Pa下达到平衡,测得N2为0.10 mol,H2为0.30 mol,NH3为0.10 mol。则该条件下达到平衡时H2的转化率为________。该温度下的平衡常数K的值为________。若升高温度,K值________(填“增大”“减小”或“不变”)。
II.一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s) + H2O(g)  CO(g) + H2(g)
CO(g) + H2(g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均分子量为M,则M的范围为
(2)在(1)中若起始时充入的是2.5 molCO(g) 和4 mol H2(g),达到平衡后混合气体的平均相对分子质量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
甲乙丙丁四种物质,在一定的条件下充分反应,测得反应前后各物质的质量分数
如图所示。下列说法正确的是

A.丙一定是这个反应的催化剂
B.该反应可能是分解反应
C.甲一定是化合物,乙一定是单质
D.参加反应的甲的质量一定等于生成的丁和乙的质量之和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com