
分析 元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti,据此解答.
解答 解:元素X的原子最外层电子数是其内层的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y基态原子的2p轨道上有3个电子,Y的核外电子排布式为1s22s22p3,则Y为N元素;Z是地壳中含量最多的元素,则Z为O元素;W的原子序数为22,则W为Ti.
(1)W核外电子数为22,基态原子的核外电子排布式为1s22s22p63s23p63d24s2;
同周期随原子序数增大,元素第一电离能呈增大强酸,氮元素原子2p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能:N>O>C,
故答案为:1s22s22p63s23p63d24s2;N>O>C;
(2)原子总数相等、价电子总数相等微粒互为得电子,与CNO-互为等电子体的一种分子、一种离子分别为CO2、SCN-等,故答案为:CO2;SCN-;
(3)二元弱酸H2C2O4的结构式为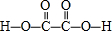 ,分子中C原子形成3个σ键,没有孤电子对,故C原子轨道的杂化类型是sp2,1mol H2C2O4分子中含有σ键的数目为7×6.02×1023,
,分子中C原子形成3个σ键,没有孤电子对,故C原子轨道的杂化类型是sp2,1mol H2C2O4分子中含有σ键的数目为7×6.02×1023,
故答案为:sp2;7×6.02×1023;
(4)氨分子与水分子间易形成氢键,NH3极易溶于水,故答案为:氨分子与水分子间易形成氢键.
点评 本题是对物质结构的考查,涉及核外电子排布、电离能、等电子体、杂化轨道、化学键、氢键等,比较全面的考查物质结构主干知识,需要学生具备扎实的基础,注意同周期中第一电离能异常情况,难度中等.


科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把pH=2的甲酸溶液稀释100倍后pH=3.5 | |
| B. | 0.1 mol•L-1的甲酸溶液的pH约为2 | |
| C. | HCOONa溶液能使酚酞试液变红 | |
| D. | 50mL l mol•L-1的甲酸溶液恰好与50mL l mol•L-1的NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不能让小学生咬铅笔头,否则会引起铅中毒 | |
| B. | 食用碱用于面包加工,可以使面包疏松 | |
| C. | 铝合金用作门窗框架,这是利用了合金硬度大的特征 | |
| D. | 烧碱和冰醋酸均为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 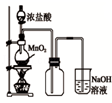 如图中:MnO2过量,盐酸能全部消耗 | B. | 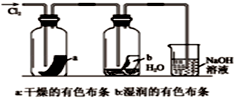 如图中:湿润的有色布条能褪色 | ||
| C. | 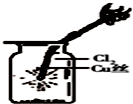 如图中:生成棕色的烟 | D. | 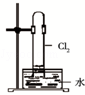 如图中:水可以充满试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
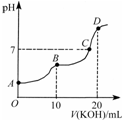
| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(HC2O4-)>c(K+)>c(H+)>c(OH-) | |
| C. | C点时:c(HC2O4-)+c(C2O42-)+c(H2C2O4)<c(K+)<c(HC2O4-)+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S2- | B. | S4O62- | C. | S2O42- | D. | SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:
常温下,向20ml 0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1 HC1溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如图,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com