
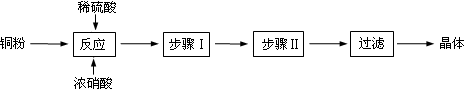
分析 (一)CuSO4•5H2O制取
Cu和稀硫酸不反应,加入浓硝酸后,二者反应生成铜离子、NO,加入足量稀硫酸,使硝酸完全转化为NO,然后过滤得到硫酸铜溶液,蒸发浓缩、冷却结晶,然后过滤得到CuSO4•5H2O晶体;
(二)(4)①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中,目的是配制一定物质的量浓度溶液;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应),二者反应方程式为CuSO4+2NaOH→Cu(OH)2↓+Na2SO4;
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸,盐酸消耗多余的HCl,反应方程式为HCl+NaOH=NaCl+H2O;
④做平行实验减小实验误差;
⑤数据处理.
(5)在滴定中,眼睛应注视锥形瓶内溶液颜色变化;滴定终点时,准确读数应该是滴定管上蓝线粗细交接点所对应的刻度;
(6)n(NaOH)=0.2500mol/L×0.1L=0.025mol,
n(HCl)=0.5000mol/L×0.010L=0.005mol,根据HCl+NaOH=NaCl+H2O知,盐酸消耗n(NaOH)=n(HCl)=0.005mol,所以与硫酸铜反应n(NaOH)=0.025mol-0.005mol=0.02mol,
根据得CuSO4+2NaOH→Cu(OH)2↓+Na2SO4,n(CuSO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.02mol=0.01mol,
100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒得m(CuSO4•5H2O)=n(CuSO4•5H2O)M(CuSO4•5H2O)=n(CuSO4).M(CuSO4•5H2O)=0.04mol×250g/mol=10g,根据质量分数公式计算其质量分数;
步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大.
解答 解:(一)CuSO4•5H2O制取
Cu和稀硫酸不反应,加入浓硝酸后,二者反应生成铜离子、NO,NO不稳定及易被氧化生成红棕色二氧化氮气体,所以看到的现象是无色气体变为红棕色气体,溶液呈蓝色;加入足量稀硫酸,使硝酸完全转化为NO,然后过滤得到硫酸铜溶液,蒸发浓缩、冷却结晶,然后过滤得到CuSO4•5H2O晶体,
(1)Cu和稀硫酸不反应,加入浓硝酸后,二者反应生成铜离子、NO,NO不稳定及易被氧化生成红棕色二氧化氮气体,所以看到的现象是无色气体变为红棕色气体,溶液呈蓝色,
故答案为:无色气体变为红棕色气体,溶液呈蓝色;
(2)离子反应方程式为3Cu+2NO3-+8H+=3Cu2++2NO+4H2O,假设有2mol硝酸反应,硝酸提供2mol氢离子,还有6mol氢离子被3mol硫酸提供,所以根据反应原理,硝酸与硫酸的理论配比2:3,
故答案为:2:3;
(3)通过以上分析知,步骤I为蒸发浓缩、步骤II为冷却结晶,
故答案为:蒸发浓缩;冷却结晶;
(二)(4)①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中,目的是配制一定物质的量浓度溶液;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应),二者反应方程式为CuSO4+2NaOH→Cu(OH)2↓+Na2SO4;
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸,盐酸消耗多余的HCl,反应方程式为HCl+NaOH=NaCl+H2O;
④做平行实验减小实验误差;
⑤数据处理,
通过以上分析知,该操作是作平行实验1-2次,故答案为:做平行实验1~2次;
(5)在滴定中,眼睛应注视锥形瓶内溶液颜色变化;滴定终点时,准确读数应该是滴定管上蓝线粗细交接点所对应的刻度,故答案为:锥形瓶中溶液颜色变化;蓝线粗细交接点;
(6)n(NaOH)=0.2500mol/L×0.1L=0.025mol,
n(HCl)=0.5000mol/L×0.010L=0.005mol,根据HCl+NaOH=NaCl+H2O知,盐酸消耗n(NaOH)=n(HCl)=0.005mol,所以与硫酸铜反应n(NaOH)=0.025mol-0.005mol=0.02mol,
根据得CuSO4+2NaOH→Cu(OH)2↓+Na2SO4,n(CuSO4)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×0.02mol=0.01mol,
100mL中硫酸铜的物质的量=0.01mol×4=0.04mol,结合Cu原子守恒得m(CuSO4•5H2O)=n(CuSO4•5H2O)M(CuSO4•5H2O)=n(CuSO4).M(CuSO4•5H2O)=0.04mol×250g/mol=10g,其质量分数=$\frac{10g}{12.500g}$=0.8;
步骤③中沉淀未洗涤,导致沉淀质量增大,所以测定结果偏大,
故答案为:0.8; 偏大.
点评 本题考查物质制备,为高频考点,侧重考查学生分析计算及实验操作能力,涉及实验操作、误差分析、化学计算等知识点,易错点是判断硝酸和硫酸物质的量之比及胆矾质量分数计算,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
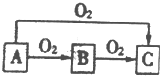 A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)
A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在少量氧气中燃烧成SO2,过量能生成SO3 | |
| B. | 铁丝在少量氯气中燃烧生成FeCl2,过量则生成FeCl3 | |
| C. | 氯水滴入淀粉碘化钾稀溶液中,少量氯水有蓝色,过量蓝色消失 | |
| D. | NaClO溶液中通少量CO2生成Na2CO3和HClO,过量生成NaHCO3和HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
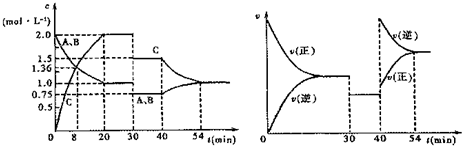
| A. | 反应方程式中的x=1 | |
| B. | 该反应为放热反应 | |
| C. | 30 min时改变的条件是加入催化剂 | |
| D. | 前30 min内A的反应速率为0.05 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳只存在金刚石和石墨两种同素异形体 | |
| B. | Mg、MgO中微粒的半径:r(O2-)>r(Mg2+)>r(Mg) | |
| C. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| D. | 相同质量的镁在足量的CO2和O2中完全燃烧,固体质量增重相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
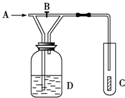 如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )
如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )| A. | 浓H2SO4 | B. | NaOH溶液 | C. | H2O | D. | 饱和NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该冶炼锌的反应属于置换反应 | |
| B. | 煤炭中起作用的主要成分是C | |
| C. | 冶炼Zn的反应方程式为:ZnCO3+2C$\frac{\underline{\;高温\;}}{\;}$Zn+3CO↑ | |
| D. | 倭铅是指金属锌和铅的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com