
【题目】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________,除此之外,装置的一个明显错误是___________________________________________________。

(2)NaOH溶液稍过量的原因是_______________________________________________。
(3)若改用60mL、0.25mol/L的H2SO4溶液和50mL、0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”或“不相等”),若实验操作均正确,则所求中和热_______________(填“相等”或“不相等”)。
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),则中和热△H=__________(取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数
【答案】环形玻璃搅拌棒小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高或其它合理答案均可)保证硫酸反应完全不相等相等C 56.8 kJ/molABD
【解析】
(1).由量热计的构造可知该装置缺少的仪器是环形玻璃搅拌棒;为了减少热量的损失,小烧杯口要用硬纸板盖住、大烧杯与小烧杯之间塞满碎纸条、大烧杯和小烧杯的杯口平齐,故答案为:环形玻璃搅拌棒;小烧杯口未用硬纸板盖住(或大烧杯内碎纸条塞少了,未将小烧杯垫的足够高或其它合理答案);
(2).实验时使用稍过量的NaOH溶液,可以让硫酸完全反应,故答案为:保证硫酸完全反应;
(3).反应放出的热量和所用酸以及碱的量的多少有关,若用60mL、0.25mol/L H2SO4和50mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,生成水的物质的量增多,反应放出的热量也增多,但是中和热均是强酸和强碱的稀溶液反应生成1mol水时放出的热量,与所用酸以及碱的量的多少无关,所以中和热相等,故答案为:不相等;相等;
(4).在中和热的实验测定中,必须要尽量减少热量的损失,所以在倒入NaOH溶液时要一次性迅速倒入,故答案为:C;
(5).①. 4次温度差分别为:3.4℃,6.1℃,3.3℃,3.5℃,第2组数据明显有误,所以删掉,温度差平均值为(3.4℃+3.3℃+3.5℃)÷3=3.4℃,0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸溶液50mL进行中和反应生成水的物质的量为0.05L×0.50mol=0.025mol,溶液的质量为:100mL×1g/mL=100g,温度变化的值△T为3.4℃,则生成0.025mol水放出的热量为Q=mc△T=100g×4.18J/(g℃)×3.4℃=1421.2J,即1.421kJ,所以实验测得的中和热△H=-1.421kJ÷0.025mol=-56.8 kJ/mol,故答案为:-56.8 kJ/mol;
②.A.中和热测定实验最关键的是保温,若实验装置保温、隔热效果差,则测定结果偏小,故A选;
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,酸碱反应放热,导致测定H2SO4的起始温度偏高,温度差偏小,测得的热量偏少,故B选;
C.做本实验时的室温和反应热的数据之间无关,故C不选;
D.在量取硫酸时仰视读数,会使得实际量取体积高于所要量取的液体体积,反应放出的热量偏多,温度差偏大,故D选,答案选ABD。


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中,不合理的是( )
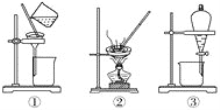
A. 洗涤沉淀时(如图①),向漏斗中加适量水,搅拌并滤干
B. 用CCl4提取碘水中的碘,选③
C. 蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干
D. 粗盐提纯,选①和②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.1moL/L的H3PO4溶液中滴加0.1moL/L的 NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是
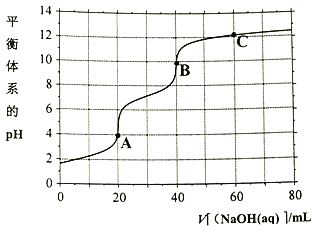
A. H3PO4溶液第一步滴定可用酚酞作指示剂
B. A点溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-)
C. 图像中A、B、C三处溶液中![]() 相等
相等
D. B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用洁净的铂丝蘸取某种无色溶液,在无色火焰上灼烧,火焰呈黄色,说明该溶液中( )
A.只有Na+B.可能有Na+,可能有K+
C.一定有K+D.一定有Na+,也可能有K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出C1O2,C1O2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
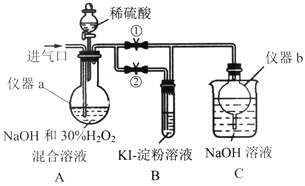
Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量C1O2,充分反应。
(1)仪器a的名称为_______,仪器b的作用是_____。
(2)装置A中生成NaC1O2的离子方程式为_______。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶______、_____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(5)B中现象为_________ 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 开启啤酒瓶后,瓶中马上泛起大量泡沫
B. H2、I2、HI混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 工业上生产硫酸的过程中使用过量的空气,以提高二氧化硫的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中离子,能在溶液中大量共存的是
A. OH-、Ca2+、NO3-、SO32-
B. Ca2+、HCO3-、Cl-、K+
C. NH4+、Ag+、NO3-、I-
D. K+、OH-、Cl-、HCO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com