
【题目】Ⅰ.某温度时,在2L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:
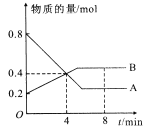
(1)该反应的化学方程式为______________________________。
(2)反应开始时至4min时,A的平均反应速率为_____________。
(3)4min时,反应是否达平衡状态?____(填“是”或“否”),8min时,v正____v逆(填“>”“<”或“=”)。
Ⅱ.把在空气中久置的铝片5.0g投入盛有500mL0.5mol·L-1盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用如图所示的坐标曲线来表示,回答下列问题:
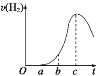
(1)曲线O→a段不产生氢气的原因,用化学方程式解释为______。
(2)曲线b→c段产生氢气的速率增加较快的主要原因是______。
(3)向溶液中加入(或改用)下列物质,能加快上述化学反应速率的是______。
A.蒸馏水B.浓盐酸C.饱和氯化钠溶液D.将铝片改用铝粉E.将盐酸改为98%的浓硫酸
【答案】2AB 0.05mol/Lmin 否 = Al2O3+6HCl=2AlCl3+3H2O 反应放热,溶液温度升高,反应速率加快 BD
【解析】
Ⅰ.(1)依据图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比写出化学方程式;
(2)依据反应速率v=![]() 计算;
计算;
(3)图象分析随时间变化AB物质的量发生变化,说明未达到平衡8分钟时AB物质的量不变,说明反应达到平衡状态;
Ⅱ.(1)根据铝的表面有一层致密的氧化膜分析解答;
(2)根据酸与活泼金属反应过程中要放热分析;
(3)根据影响化学反应速率的因素分析。
Ⅰ.(1)图象分析A为反应物,B为生成物,物质的量不变化说明反应达到平衡状态,依据AB消耗的物质的量之比计算得到化学方程式的计量数之比,A物质的量变化=0.8mol0.2mol=0.6mol;B变化物质的量=0.5mol0.2mol=0.3mol,AB反应的物质的量之比2:1,所以反应的化学方程式:2AB;
(2)反应开始至4min时,A物质的量变化=0.8mol0.4mol=0.4mol,A的平均反应速率=![]() =0.05mol/Lmin;
=0.05mol/Lmin;
(3)图象分析,4分钟后,随时间变化A、B物质的量发生变化,说明未达到平衡,8分钟时A、B物质的量不变,说明反应达到平衡状态,正逆反应速率相等;
Ⅱ.(1)因铝的表面有一层致密的Al2O3能与HCl反应得到盐和水,无氢气放出,发生反应为:Al2O3+6HCl=2AlCl3+3H2O;
(2)在反应过程中,浓度减小,反应速率减小,但反应放热,溶液温度升高,反应速率加快,且后者为主要因素;
(3)A.加入蒸馏水,酸的浓度减少,反应速率减慢,故A错误;
B.加入浓盐酸,酸的浓度增大,反应速率加快,故B正确;
C. 加入饱和氯化钠溶液,酸的浓度减少,反应速率减慢,故C错误;
D.改用铝粉,固体的表面增大,反应速率加快,故D正确;
E.将盐酸改为98%的浓硫酸,浓硫酸具有强氧化性,使金属铝发生钝化,反应停止,反应速率减慢,故E错误;
答案选BD。


科目:高中化学 来源: 题型:
【题目】H2R为二元弱酸,向一定体积的0.1mol/L的H2R溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2R、HR-、R2-)的物质的量分数a(X)随pH的变化曲线如图所示[a(X)=c(X)/[c(H2R)+c(HR-)+c(R2-)]]。下列说法错误的是
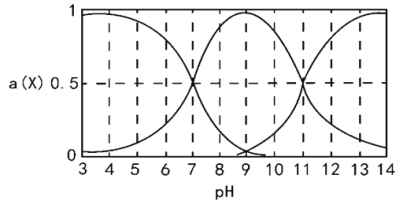
A. 常温下,K2(H2R)=1.0×10-11
B. 常温下,HR-在水中的电离程度大于其水解程度
C. pH=9时, c(Na+)>c(HR-)+2c(R2-)
D. pH=7时,c(H2R)=c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,且原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置___。
(2)D的最高价氧化物的水化物,所含化学键类型:___、___。
(3)B、C、D、E简单离子半径由大到小顺序为:___(填元素符号)。
(4)用电子式表示E的氢化物的形成过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应且正确的是( )
A. 乙醇与溴化氢的水溶液共热:CH3CH2OH+HBr![]() CH3CH2Br+H2O
CH3CH2Br+H2O
B. 甲烷和氯气在光照条件下的反应:2CH4+Cl2![]() 2CH3Cl+H2
2CH3Cl+H2
C. 苯酚溶液中滴入NaOH溶液:H++ OH-![]() H2O
H2O
D. 苯酚钠溶液中通入少量CO2:CO2+ H2O + 2C6H5O-![]() 2C6H5OH + 2CO32—
2C6H5OH + 2CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子序数与最外层电子数之间的关系图,下列说法中正确的是( )

A.元素对应的离子半径:Z>X>R>W
B.简单氢化物的沸点:W>R>Y>Z
C.M、N、R、W的简单离子均能促进水的电离
D.Z、X、R、W的最高价氧化物对应的水化物均能与N的单质反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断正确的是( )
A. 新戊烷与2,2二甲基丙烷的结构不同
B. 2,2,3,3四甲基丁烷在核磁共振谱(![]() )上有两组峰
)上有两组峰
C. CH2=CH—CH=CH—CH3和CH3CH2C≡CCH3可能共面的碳原子数都是5
D. C6H12分子中所有碳原子不可能共面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1molCO2和3molH2,在500℃下发生发应,CO2(g)+3H2(g)![]() CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
CH3OH(g) + H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
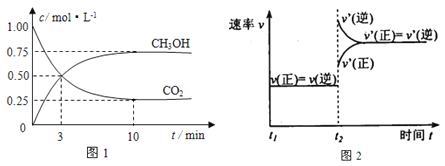
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=_________________。500℃达平衡时,CH3OH(g)的体积分数为_______,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为____反应(填“放热”或“吸热”)。
(2)500℃该反应的平衡常数为_______(保留两位小数),若提高温度到800℃进行,达平衡时,K值_____(填“增大”“减小”或“不变”)。
(3)下列措施中不能使CO2的转化率增大的是________________。
A.在原容器中再充入1mol H2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂 E.将水蒸气从体系中分离出
(4)500℃条件下,测得某时刻,CO2(g)、H2(g)、CH3OH(g)和H2O(g)的浓度均为0. 5mol/L,则此时v(正)_____v(逆)(填“>”“<”或“=”)。
(5)下列措施能使n(CH3OH)/n(CO2)增大的是______。
A.升高温度 B.在原容器中充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于四种装置的叙述不正确的是( )
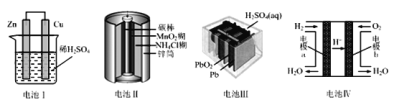
A.电池Ⅰ:正极发生的反应为2H++2e﹣═H2↑
B.电池Ⅱ:锌筒做负极,发生氧化反应
C.电池Ⅲ:是最早使用的充电电池,又称为二次电池
D.电池Ⅳ:外电路中电子由电极b通过导线流向电极a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为______(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为__________;
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是____(填标号)。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)已知NaHCO3溶液呈碱性,原因是____(用离子方程式表示);请写出该溶液中各离子浓度的大小_____________,电荷守恒表达式_________;
II:按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的____________。
(2)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_______;
(3)将25℃下pH=12的NaOH溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com