
| A. | 具有氧化性 | B. | 具有还原性 | C. | 具有漂白性 | D. | 含有极性键 |
分析 过氧化钙与过氧化钠相似,其中O元素为-1价,所以过氧化钙具有强氧化性,可以杀菌漂白,但-1价的氧元素也可以升高到0价,则过氧化钙也具有还原性,据此分析.
解答 解:A、过氧化钙与过氧化钠相似,其中O元素为-1价,所以过氧化钙具有强氧化性,故A正确;
B、过氧化钙中-1价的氧元素也可以升高到0价,则过氧化钙也具有还原性,故B正确;
C、过氧化钙与过氧化钠相似,其中O元素为-1价,所以过氧化钙具有强氧化性,可以杀菌漂白,故C正确;
D、过氧化钙与过氧化钠结果相似,只含离子键和O-O非极性键,不含极性键,故D错误;
故选D.
点评 本题考查了过氧化物性质的推断应用,依据过氧化钠的性质分析类推过氧化钙的性质是解题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
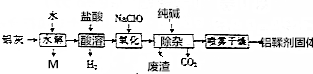
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫原子的结构示意图: | |
| B. | HCl的电子式: | |
| C. | 乙酸的结构式:C2H4O2 | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 3:4 | D. | 1:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
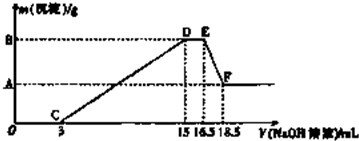
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
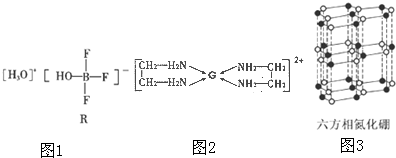
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林(
)2]的消炎作用比阿司匹林强十多倍,它为亮蓝色结晶粉末,遇强酸解离为阿司匹林( ,M=180)和Cu2+;
,M=180)和Cu2+;| 阿司匹林溶解质量 | 阿司匹林铜的溶解质量 | |
| 氯仿 | 0.4g | 不溶 |
| 无水乙醇 | 0.9g | 不溶 |
| 蒸馏水 | 不溶 | 不溶 |
| 实验编号 | 阿司匹林:无水硫酸铜/物质的量之比 | 产率% | ||
| X1 | X2 | 平均值 | ||
| 1 | 1:1 | 76.6 | 78.1 | 77.4 |
| 2 | 2:1 | 78.6 | 75.1 | 76.8 |
| 3 | 3:1 | 93.9 | 95.9 | 94.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com