
| A. | 溶液的pH增大 | B. | NH3•H2O的电离平衡常数增大 | ||
| C. | NH3•H2O的电离程度增大 | D. | NH3•H2O溶液中所有离子浓度减小 |
分析 一水合氨是弱电解质,电离生成铵根离子和氢氧根离子,溶液显碱性,加水稀释促进一水合氨电离,平衡状态下的微粒浓度减小,一定温度下水溶液中存在离子积常数,溶液中氢离子浓度增大,注意电离平衡常数只与温度有关.
解答 解:A.在0.10mol•L-1 NH3•H2O的溶液中,存在电离平衡,NH3•H2O?NH4++OH-,加水稀释后溶液中氢氧根离子浓度减小,溶液PH减小,故A错误;
B.溶液温度不变,电离平衡常数只随温度变化,溶液稀释,NH3•H2O的电离平衡常数不变,故B错误;
C.依据化学平衡移动原理可知,改变一个条件,平衡向减弱这种改变的方向进行,加入水稀释,促进电离平衡正向进行,NH3•H2O的电离程度增大,故C正确;
D.在0.10mol•L-1 NH3•H2O的溶液中存在电离平衡,NH3•H2O?NH4++OH-,加水稀释后,NH3•H2O、NH4+、OH-离子浓度都减小,水溶液中存在离子积常数,氢氧根离子浓度减小,则氢离子浓度增大,所以溶液中离子浓度不一定都减小,故D错误;
故选C.
点评 本题考查弱电解质的电离平衡及其影响因素,题目难度中等,明确溶液稀释促进电离,温度不变,电离平衡常数不变和离子积常数的理解应用,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 超级病菌NDM-l几乎对所有抗生素都具有抗药性,死亡率很高.为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适 宜的物质 | |
| B. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| C. | 白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>② | B. | ①<② | C. | ①=② | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酸性KMnO4溶液将Fe2+氧化成Fe3+,再转化为Fe(OH)3沉淀除去 | |
| B. | 用ZnO调节浸出液的酸碱性,可使某些离子形成氢氧化物沉淀 | |
| C. | 在实际生产过程中,加入Ag2SO4可除去Cl-,是利用了沉淀转化的原理 | |
| D. | 也可以用ZnCO3代替ZnO调节溶液的酸碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用惰性电极电解饱和食盐水,每转移1mol电子,生成11.2L的H2 | |
| B. | 1molMg与足量的N2完全反应时,转移的电子数为3NA | |
| C. | 精炼铜时,当阳极质量减少6.4g时,电路中转移电子数为0.2NA | |
| D. | 常温下,11.2L的甲烷气体中含有的氢、碳原子数之比为4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若t℃时,0.05mol•L-1的Ba(OH)2溶液pH=11,t=25℃ | |
| B. | 常温下,向pH=a的醋酸溶液中加入等体积等浓度的硫酸后,pH=a+1 | |
| C. | 常温下,若c1mol•L-1的氨水与c2mol•L-1的盐酸等体积混合pH=7,则c1>c2 | |
| D. | 等体积等pH的CH3COOH溶液、盐酸分别与足量铝粉反应,盐酸生成H2的量更多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
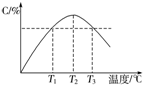
| A. | 0~5 min,C物质的平均反应速率为0.04 mol•L-1•min-1 | |
| B. | 图中温度T1时的正反应速率等于温度T3时的正反应速率 | |
| C. | 该反应温度T2时的平衡常数大于温度T3时的平衡常数 | |
| D. | 图中T2时,若只增大压强,则正、逆反应速率不改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )
实验室采购了部分化学药品.如图是从化学试剂商店买回的硫酸试剂标签上的部分内容.下列说法正确的是( )| A. | 该硫酸的物质的量浓度为9.2mol•L-1 | |
| B. | 1molAl与足量的该硫酸反应产生3g氢气 | |
| C. | 这种硫酸在常温下不能使铁钝化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取该硫酸12.5 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com