
【题目】向某Na2CO3、NaHCO3的混合溶液中加入少量的BaCl2,测得溶液中![]() 与
与![]() 的关系如图所示,下列说法正确的是
的关系如图所示,下列说法正确的是
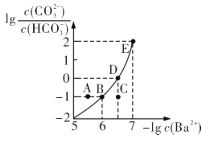
A.该溶液中![]()
B.B、D、E三点对应溶液pH的大小顺序为B>D>E
C.A、B、C三点对应的分散系中,A点的稳定性最差
D.D点对应的溶液中一定存在2c(Ba2+ ) +c(Na+ )+c(H+ )=c(CO32- )+c(OH- )+c(Cl- )
【答案】C
【解析】
A.该溶液K1 > K2,因此溶液中![]() ,故A错误;
,故A错误;
B.![]() 越大,则c(Ba2+)越小,c(CO32-)越大,碱性越强,因此B、D、E三点对应溶液pH的大小顺序为E >D > B,故B错误;
越大,则c(Ba2+)越小,c(CO32-)越大,碱性越强,因此B、D、E三点对应溶液pH的大小顺序为E >D > B,故B错误;
C.A、B、C三点对应的分散系中,A点为过饱和溶液,会生成碳酸钡沉淀,因此A点的稳定性最差,故C正确;
D.D点对应的溶液,根据电荷守恒,一定存在2 c(Ba2+ ) + c(Na+ )+ c(H+ )=2 c(CO32-) + c(OH-) + c(Cl-) + c(HCO3-),由于c(CO32-) = c(HCO3-),还可以为2 c(Ba2+ ) + c(Na+ )+ c(H+ ) = 3c(CO32-) + c(OH-) + c(Cl-),故D错误。
综上所述,答案为C。


科目:高中化学 来源: 题型:
【题目】某兴趣小组用铝箔制备![]() 、
、![]() 及明矾大晶体,具体流程如下:
及明矾大晶体,具体流程如下:

已知:抽滤是一种过滤的方式。
请回答:
(1)步骤Ⅰ中的化学方程式___________;
(2)步骤Ⅱ中生成![]() 的离子方程式_____________;
的离子方程式_____________;
(3)写出![]() 的电离方程式_____________。
的电离方程式_____________。
(4)步骤Ⅲ,下列操作合理的是______。
A. 坩埚洗净后,无需擦干,即可加入![]() 灼烧
灼烧
B. 为了得到纯![]() ,需灼烧至恒重
,需灼烧至恒重
C. 若用坩埚钳移动灼热的坩埚,需预热坩埚钳
D. 坩埚取下后放在石棉网上冷却待用
E. 为确保称量准确,燃烧后应趁热称重
(5)由溶液A制备![]() 的装置如图。
的装置如图。

①通入HCl的作用是___________和降低![]() 的溶解度,使其以_______(填化学式)晶体形式析出。
的溶解度,使其以_______(填化学式)晶体形式析出。
②烧杯中NaOH溶液的作用是___________,倒置漏斗的作用是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室石蜡催化裂化的装置如图所示,关于实验操作或叙述错误的是( )

A.试管Ⅰ连的玻璃导管加长是为使气态石蜡冷凝回流
B.装置Ⅱ中冷水的作用是冷凝收集裂化油
C.试管Ⅲ中溶液颜色变浅甚至褪色可说明有乙烯生成
D.酸性KMnO4溶液若倒吸可加快褪色速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟及其化合物用途十分广泛,回答下列问题:
(1)氟化物OF2、NF3、SiF4、PF5、SF6中,中心原子采取sp3杂化的是__。
(2)[H2F]+[SbF6]-(氟锑酸)是一种超强酸。锑的价电子排布式为__。阳离子[H2F]+的空间构型为__,写出[H2F]+的等电子体__(分子和离子各举一例)。
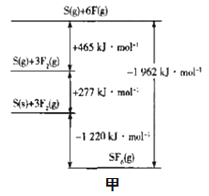
(3)SF6被广泛用于高压电器设备的绝缘介质。根据__理论,可判断出其空间构型为正八面体。SF6的键能可通过类似Born-Haber循环能量构建能量图(图甲)计算键能,则S-F的键能为___kJmol-1。
(4)工业上电解Al2O3制取单质铝,常利用冰晶石Na3[AlF6]降低Al2O3的熔点。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Na3[AlF6]+3CO2↑+9H2O。
①测定气态HF的摩尔质量时,往往得不到20gmol-1的数据,原因是__。
②冰晶石的晶体不导电,但熔融时能导电,则在冰晶石晶体中存在__(填序号)。
a.离子键 b.极性键 c.配位键 d.范德华力
③反应物中元素(氢除外)的第一电离能从大到小的顺序为__(用元素符号表示)。
④工业上不用电解熔点更低的AlCl3制取铝的原因为__。
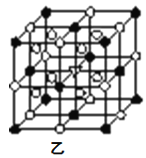
⑤冰晶石由两种微粒构成,冰晶石的晶胞结构如图乙所示,●位于大立方体的顶点和面心,○位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是__(填具体的微粒符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,由于石油价格不断上涨,以煤为原料制备一些化工产品的前景又被看好。如图是以煤为原料生产聚氯乙烯(PVC)和人造羊毛的合成路线。
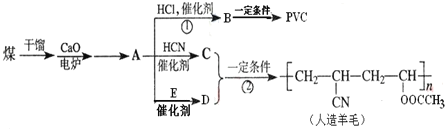
请回答下列问题:
(1)写出反应类型:反应①___;反应②___。
(2)写出结构简式:PVC___;E___。
(3)按要求写出化学方程式:
①→A:___;
②检验E中含氧官能团:___;
③Y+Z生成乙酸乙酯:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以环己醇为原料制取己二酸[HOOC(CH2)4COO H]的实验流程如下:
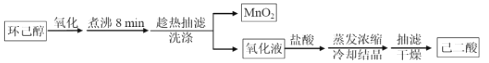
其中“氧化”的实验过程:在250mL四颈烧瓶中加入50 mL水和3.18g碳酸钠,低速搅拌至碳酸钠溶解,缓慢加入9.48g(约0.060 mol)高锰酸钾,按图示搭好装置:
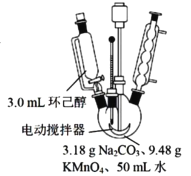
打开电动搅拌,加热至35℃,滴加3.2 mL(约 0.031 mol) 环己醇,发生的主要反应为:![]()
![]() KOOC(CH2)4COOK H<0
KOOC(CH2)4COOK H<0
(1)“氧化”过程应采用____________加热
(2)“氧化”过程为保证产品纯度需要控制环己醇滴速的原因是:_______________。
(3)为证明“氧化”反应已结束,在滤纸上点1滴混合物,若观察到___________则表明反应已经完成。
(4)“趁热抽滤”后,用___________进行洗涤(填“热水”或“冷水")。
(5)室温下,相关物质溶解度如表:
化学式 | 己二酸 | NaCl | KCl |
溶解度g/100g水 | 1.44 | 35.1 | 33.3 |
“蒸发浓缩”过程中,为保证产品纯度及产量,应浓缩溶液体积至_________(填标号)
A.5mL B.10mL C.15mL D.20mL
(6)称取己二酸(Mr-=146 g/mol)样品0.2920 g,用新煮沸的50 mL 热水溶解,滴入2滴酚酞试液,用0.2000 mol/L NaOH 溶液滴定至终点,消耗 NaOH 的平均体积为 19.70 mL。NaOH 溶液应装于____________(填仪器名称),己二酸样品的纯度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中阴离子结合质子能力最强的是__________。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) ___________。
③向NaCN溶液通入少量CO2反应的化学方程式是_____________________________。
(2)①一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____________;此时c(HCN)/c(CN-)=____________。
②常温下,NaCN与过氧化氢溶液反应,生成NaHCO3和能使湿润的红色石蕊试纸变蓝色的气体,大大降低其毒性。该反应的化学方程式是___________________________。
(3)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol·L-1 Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为_____________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡常用作媒染剂和有机合成中的氯化催化剂。实验室可用熔融的锡(熔点 232 ℃)与 Cl2反应制备 SnCl4,装置如图。
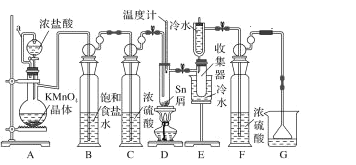
已知:①SnCl2、SnCl4 有关物理性质:
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
②SnCl4 极易水解生成 SnO2·xH2O。回答下列问题:
(1)导管 a 的作用是_____,装置 A 中发生反应的离子方程式为_____。
(2)当观察到装置 F 液面上方_____时才开始点燃 D 处的酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的是①_________;②_____。
(3)若上述装置中缺少装置 C( 其它均相同) ,则D处具支试管中发生的主要副反应化学方程式为_____。
(4)Cl2和锡的反应产物有 SnCl4 和 SnCl2,为防止产品中带入过多的 SnCl2,可使用的温度范围是_____。
(5)滴定分析产品中 Sn(Ⅱ)的含量:用分析天平称取 5.000g 产品于锥形瓶中,用蒸馏水溶解,加入淀粉溶液,用 0.1000 mol·L-1 的碘标准溶液滴定至终点时消耗 20.00 mL,则产品中 Sn(Ⅱ)的含量为_____。(已知 Sn2++I2=2I-+Sn4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钠晶体 ![]() 俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿
俗称红矾钠,在工业方面有广泛用途.我国目前主要是以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、MgO、
、MgO、![]() 等杂质
等杂质![]() 为主要原料进行生产,其主要工艺流程如下:
为主要原料进行生产,其主要工艺流程如下:
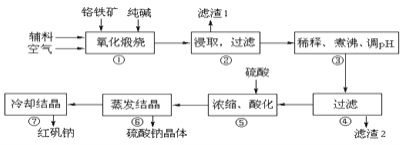
①中涉及的主要反应有:
主反应:![]()
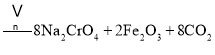
副反应: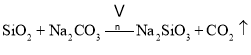 、
、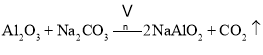
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
沉淀物 |
|
|
|
|
完全沉淀时溶液pH |
|
|
|
|
试回答下列问题:/span>
![]() “①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 ______
![]() “③”中调节pH至
“③”中调节pH至![]() ,目的是 ______ .
,目的是 ______ .
![]() “⑤”中加硫酸酸化的目的是使
“⑤”中加硫酸酸化的目的是使![]() 转化为
转化为![]() ,请写出该平衡转化的离子方程式: ______ .
,请写出该平衡转化的离子方程式: ______ .
![]() 称取重铬酸钠试样
称取重铬酸钠试样![]() 配成250mL溶液,取出
配成250mL溶液,取出![]() 于碘量瓶中,加入10mL
于碘量瓶中,加入10mL![]() 和足量碘化钠
和足量碘化钠![]() 铬的还原产物为
铬的还原产物为![]() ,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用
,放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用![]() 标准溶液滴定
标准溶液滴定![]()
①判断达到滴定终点的依据是: ______ ;
②若实验中共用去![]() 标准溶液
标准溶液![]() ,所得产品的中重铬酸钠晶体的纯度
,所得产品的中重铬酸钠晶体的纯度![]() 设整个过程中其它杂质不参与反应
设整个过程中其它杂质不参与反应![]() ______ .
______ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com