
| 乙醛的结构特点 | 可能的化学性质 |
| 有C=O双键,不饱和 | 与H2发生加成反应,乙醛表现氧化性 |
CHO中C-H键极性较强 | CHO中C-H键被氧化,变为C-OH |
| 实验 | 现象 | 结论 |
| 取适量乙醛溶液,滴加高锰酸钾酸性溶液 | 高锰酸钾溶液紫色变浅(褪去) | 乙醛能被高锰酸钾氧化 |
| 向新制银氨溶液中加入几滴乙醛溶液,水浴加热 | 试管壁上出现银镜(一层光亮如镜的银) | 乙醛将银氨溶液还原 |
| 向新制氢氧化铜悬浊液中加入适量乙醛溶液,加热 | 出现红色沉淀 | 乙醛被氢氧化铜氧化 |
分析 (1)乙醛中甲基与醛基相连,该有机物的结构简式为:CH3CHO,有C=O双键,不饱和,可发生加成反应,有机反应中加氧或脱氢为氧化反应,脱氧或加氢为还原反应;
(2)在催化剂的作用下,乙醛与氢气发生加成反应生成乙醇;
(3)①高锰酸钾具有强氧化性,取适量乙醛溶液,滴加高锰酸钾酸性溶液,高锰酸钾溶液紫色变浅(褪去),说明乙醛能被高锰酸钾氧化;
②醛基能被弱氧化剂氧化,新制银氨溶液中+1价的银能氧化醛,新制氢氧化铜悬浊液中+2价的铜具有氧化性,能氧化醛基,同时生成砖红色的氧化亚铜;
(4)气体的密度与摩尔质量成正比,根据有机物蒸汽对氢气的相对密度为15计算出该有机物的相对分子量;根据4.4gCO2和1.8gH2O计算出二氧化碳和水的物质的量,根据摩尔质量守恒计算氧元素的含量,据此书写分子式,根据分子中有醛基推断其结构,根据其结构计算3g该物质与足量的新制氢氧化铜反应,生成沉淀的质量.
解答 解:(1)加成反应指有机物分子中的不饱和双键或叁键发生断裂,不饱和原子与其它原子或原子团直接结合生成新化合物的反应,乙醛为: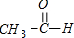 ,含有C=O双键,与H2反应,反应中C=C双键中其中1个碳碳键断裂,不饱和的C原子与氢原子直接结合:
,含有C=O双键,与H2反应,反应中C=C双键中其中1个碳碳键断裂,不饱和的C原子与氢原子直接结合: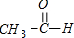 +H2$→_{△}^{催化剂}$CH3CH2OH,所以该反应属于加成反应,该反应为乙醛的加氢为还原反应,乙醛表现为氧化性,
+H2$→_{△}^{催化剂}$CH3CH2OH,所以该反应属于加成反应,该反应为乙醛的加氢为还原反应,乙醛表现为氧化性,
故答案为:加成;氧化;
(2)在催化剂的作用下,乙醛与氢气发生加成反应:CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH,故答案为:CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH;
(3)高锰酸钾具有强氧化性,与乙醛反应CH3CHO+2KMnO4+3H2SO4=2MnSO4+K2SO4+5CH3COOH+3H2O,高锰酸钾溶液紫色变浅(褪去),证明乙醛能被高锰酸钾氧化,乙醛发生银镜反应:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COONH4+2Ag↓+3NH3+H2O,生成光亮的银,乙醛与新制氢氧化铜发生反应生成乙酸、氧化亚铜和水,方程式为:CH3CHO+2Cu(OH)2$\stackrel{△}{→}$CH3COOH+Cu2O↓+2H2O,
故答案为:
| 现象 |
| 高锰酸钾溶液紫色变浅(褪去) |
| 银镜(一层光亮如镜的银) |
| 出现红色沉淀 |
点评 本题考查了醛基官能团的性质和检验应用,乙醛的氧化实验,注意从醛基能加成、能被氧化等性质分析,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题
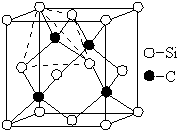 碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:
碳、氮、氟、硅、铜等元素的化合物广泛存在于自然界,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温低压 | B. | 低温低压 | C. | 低温高压 | D. | 高温高压 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
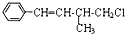
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作、现象 | 解释或结论 |
| A | 某溶液中先加稀HCl酸化,再加AgNO3,产生白色沉淀 | 原溶液有Cl-存在 |
| B | Cl2能使湿润的红布条褪色 | Cl2具有漂白性 |
| C | Na2SiO3溶液中通入CO2产生白色胶状沉淀 | H2CO3酸性大于H2SiO3 |
| D | 光照氯水有气泡产生 | 该气体一定是Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Na+、ClO- | B. | Cu2+、Ba2+、OH-、Cl- | ||
| C. | Ca2+、K+、Al3+、CO32- | D. | NH4+、NO3-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和硫酸铁均可用作净水剂 | |
| B. | 有单质参加的化学反应一定是氧化还原反应 | |
| C. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| D. | 相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比是1:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com