
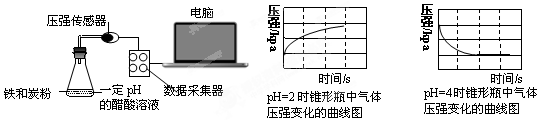
| A. | 溶液pH≤2时,生铁发生析氢腐蚀 | |
| B. | 生铁的腐蚀中化学腐蚀比电化学腐蚀更普遍 | |
| C. | 在酸性溶液中生铁可能发生吸氧腐蚀 | |
| D. | 两溶液中负极反应均为:Fe-2e-═Fe2+ |
分析 根据压强与时间关系图知,pH=2的醋酸溶液中压强随着反应的进行而逐渐增大,说明该反应发生析氢腐蚀,pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,根据原电池原理来分析解答.
解答 解:A.根据PH=2的溶液中压强与时间的关系知,压强随着反应的进行而逐渐增大,说明该装置发生析氢腐蚀,则溶液pHpH≤2时,生铁发生析氢腐蚀,故A正确;
B.金属的腐蚀以电化学腐蚀为主,所以生铁的腐蚀中电化学腐蚀更普遍,故B错误;
C.pH=4的醋酸溶液中压强随着反应的进行而逐渐减小,说明发生吸氧腐蚀,pH=4的醋酸溶液呈酸性,所以在酸性溶液中生铁可能发生吸氧腐蚀,故C正确;
D.两个溶液中都发生电化学腐蚀,铁均作负极,电极反应式为Fe-2e-=Fe2+,故D正确;
故选B.
点评 本题考查了析氢腐蚀和吸氧腐蚀,根据压强与时间的关系分析吸氧腐蚀和析氢腐蚀、反应速率大小、电极反应等知识点,难度中等.


科目:高中化学 来源: 题型:选择题
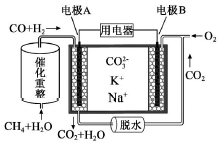
| A. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 反应CH4+H2O $\frac{\underline{催化剂}}{△}$ 3H2+CO,每消耗1molCH4转移12mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入盐酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 将SO2中通入硝酸钡溶液中 | 有白色沉淀生成 | BaSO3不溶于硝酸 |
| C | 同温同压下,用pH试纸测定相同浓度的碳酸钠和硫酸钠溶液的酸碱性 | 碳酸钠溶液显碱性,硫酸钠溶液显中性 | 碳酸钠发生了水解 |
| D | 向淀粉KI溶液中通入Cl2 | 溶液先变蓝后褪色 | Cl2先表现氧化性、后表现强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,推断溶液中含有NH4+ | |
| B. | 无色试液在焰色反应中呈黄色,推断试液是钠盐溶液,不含钾盐 | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,推断溶液中含有CO32- | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,推断溶液中含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.
托盘天平、容量瓶、量筒是常见的中学化学计量仪器,熟知这些仪器的使用是定量研究化学的基础.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入银氨溶液,并水浴加热 | |
| B. | 加入2~3滴石蕊试液 | |
| C. | 先加入浓NaOH溶液,加热蒸馏,把蒸馏出的物质加银氨溶液并水浴加热 | |
| D. | 直接蒸馏,把蒸馏出的物质加NaOH溶液调至碱性,再加银氨溶液,并水浴加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A(g)+2B(g)?2C(g);△H1>0 | B. | A(g)+B(g)?C(g)+D(g);△H2>0 | ||
| C. | A(s)+2B(g)?C(g);△H3>0 | D. | A(s)?B(g)+C(g);△H4<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com