
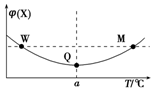
 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)?3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | 升高温度,平衡常数减小 | |
| B. | W、M两点Y的正反应速率相等 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | M点时,Y的转化率最大 |
分析 由图可知,开始反应物的含量减少,Q点达到平衡状态,之后升高温度时X的体积分数增大,可知升高温度平衡逆向移动,则正反应为放热反应,以此来解答.
解答 解:A.Q点后升高温度平衡逆向移动,正反应为放热反应,则升高温度,平衡常数减小,故A正确;
B.温度越高,反应速率越快,则M点Y的反应速率大,故B错误;
C.恒该反应为气体体积不变的反应,容时平衡后充入Z,达到新平衡时,与原平衡为等效平衡,Z的体积分数不变,故C错误;
D.Q点为平衡点,则Q点时Y的转化率最大,故D错误;
故选A.
点评 本题考查化学平衡移动,为高频考点,把握图象分析、平衡移动、平衡状态的判断为解答的关键,侧重分析与应用能力的考查,注意该反应为放热反应,选项C为解答的难点,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制槽车可用来贮运浓硫酸、浓硝酸是因为常温下铝和浓硫酸、浓硝酸不反应 | |
| B. | 两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应,产生的氢气前者多 | |
| C. | 合金的熔点一般比组成它的各成分的熔点都高 | |
| D. | 工业上常利用铝热反应冶炼难熔金属,如钒、铬、锰 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:| A. | 保持压强不变,升高反应温度 | |
| B. | 保持温度不变,增大容器体积 | |
| C. | 保持温度和容器体积不变,充入1 mol C(g) | |
| D. | 保持温度和压强不变,充入1 mol C(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
| Ksp | 2.2×10-20 | 2.6×10-39 | 1.7×10-7 | 1.3×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
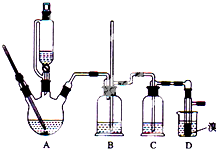 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示(加热及夹持装置省略):| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由同种分子构成的物质一定是纯净物 | |
| B. | 纯净物一定由分子构成 | |
| C. | 混合物肯定是由两种以上的元素组成的 | |
| D. | 含有氧元素的化合物就是氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com