
 二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:
二甲醚(CH3OCH3)以其优良的性质,被称为21世纪的新型“清洁能源”,在未来可能替代柴油和液化气作为洁净液体燃料使用.工业上以C0和H2为原料生产CH30CH3的新工艺主要发生三个反应:| 反应时间/min | 0 | 1 | 2 | 3 | 4 |
| c(CH3OH)/mol?L-1 | 0.51 | 0.2 | 0.1 | 0.01 | 0.01 |
| c(CH3OCH3)c(CO2) |
| c3(CO)c3(H2) |
| c(CH3OCH3)c(CO2) |
| c3(CO)c3(H2) |
| 0.6mol/L |
| 3min |
| 1.2 |
| 0.8×(y-2.4)2 |
| 0.2 |
| 0.4×2.42 |
| 0.25×0.25 |
| 0.012 |
| (1.0+0.25)×0.25 |
| 0.032 |


科目:高中化学 来源: 题型:
| A、SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色 |
| B、可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道 |
| C、用玻璃试剂瓶盛装NaOH等强碱溶液时,不能盖上玻璃塞 |
| D、浓硫酸溅到皮肤上,要立即用大量的水冲洗,然后涂点稀氨水或涂点碳酸氢钠,最后再用水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、分子式为C10H10O3,是一种芳香烃 |
| B、能发生加聚反应,也能发生酯化反应 |
| C、1 mol A能分别与1 mol金属钠、2mol NaOH反应 |
| D、A分子中所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
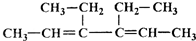

 R、R′代表烃基.
R、R′代表烃基.查看答案和解析>>
科目:高中化学 来源: 题型:
 ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:
ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com