
下列晶体按A1型方式进行紧密堆积的是( )。
A.干冰、NaCl、金属铜
B.ZnS、金属镁、氮化硼
C.水晶、金刚石、晶体硅
D.ZnS、NaCl、金属镁
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练3.4几类其他聚集状态物质练习卷(解析版) 题型:填空题
研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”。图Ⅰ是水和“热冰”的计算机模拟图,图中球代表水分子中的原子。
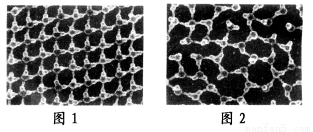
图Ⅰ
(1)图中较大的球代表________原子,其原子结构示意图是________。水分子中氢氧原子间的化学键是________(填“共价键”或“离子键”)。
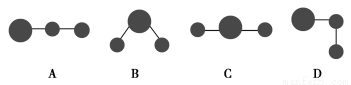
(2)用球棍模型表示的水分子结构是________。
图Ⅱ
(3)已知水分子中氧原子一端带部分负电荷,氢原子一端带部分正电荷,在外加电场作用下,水结成冰。图Ⅰ中模拟“热冰”的示意图是________(填“图1”或“图2”),理由是_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练2.2.1典型分子空间构型练习卷(解析版) 题型:选择题
下列各组分子中都属于含极性键的非极性分子的是( )。
A.CO2、H2S B.C2H4、CH4
C.Cl2、C2H2 D.NH3、HCl
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.2金属晶体与离子晶体练习卷(解析版) 题型:选择题
NaF、NaI、MgO晶体均为离子晶体,根据下列数据,这三种晶体的熔点高低顺序是( )。
物质 | ①NaF | ②NaI | ③MgO |
离子电荷数 | 1 | 1 | 2 |
离子间距离/10-10 m | 2.31 | 3.18 | 2.10 |
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 3.1认识晶体练习卷(解析版) 题型:填空题
(1)水在不同的温度和压强条件下可以形成11种不同结构的晶体,密度从比水轻的0.92 g·cm-3到约为水的一倍半。冰是人们迄今已知的由一种简单分子堆积出结构花样最多的化合物。其中冰-Ⅶ的晶体结构为一个如下图所示的立方晶胞,每个水分子可与周围____________个水分子以氢键结合,晶体中,1 mol水可形成________ mol氢键。
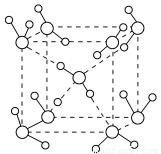
(2)已知下列元素的电负性数据:H为2.1,O为3.5,F为4.0。OF2与水的立体结构相似,但水分子的极性比OF2强得多,其原因有:①OF2中氧原子上有两对孤对电子,抵消了F—O键中共用电子对偏向F而产生的极性;②从电负性上看,___________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:选择题
已知H2、O2、Cl2、N2分子中共价键的键能依次为436 kJ·mol-1、497 kJ·mol-1、243 kJ·mol-1、946 kJ·mol-1,
(1)下列叙述正确的是 ( )。
A.N—N键键能为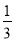 ×946=315.3kJ·mol-1
×946=315.3kJ·mol-1
B.氮分子中共价键的键长比氢分子中共价键的键长短
C.氧分子中氧原子是以共价单键结合的
D.氮分子比氯分子稳定
(2)计算反应3Cl2+2NH3=N2+6HCl(EN-H=391 kJ·mol-1,EH-Cl=432 kJ·mol-1)的反应热。
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 2.1.2键参数练习卷(解析版) 题型:选择题
下列分子中键能最大的是( )。
A.HF B.HCl C.HBr D.HI
查看答案和解析>>
科目:高中化学 来源:2014年高二鲁科版选修3化学规范训练 1.3原子结构与元素性质练习卷(解析版) 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
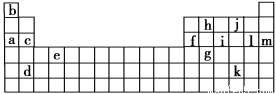
(1)下列________(填写编号)组元素的单质可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。
核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A.原子核对核外电子的吸引力
B.形成稳定结构的倾向
下表是一些气态原子失去核外不同电子所需的能量(kJ·mol-1):
| 锂 | X | Y |
失去第一个电子 | 519 | 502 | 580 |
失去第二个电子 | 7 296 | 4 570 | 1 820 |
失去第三个电子 | 11 799 | 6 920 | 2 750 |
失去第四个电子 | —— | 9 550 | 11 600 |
①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量__________________________________。
②表中X可能为以上13种元素中的(填写字母)____________元素。用元素符号表示X和j形成化合物的化学式________________。
③Y是元素周期表中第________族元素。
④以上13种元素中,________(填写字母)元素原子失去核外第一个电子需
要的能量最多。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学苏教版选修2 6.1环境污染的化学防治练习卷(解析版) 题型:填空题
目前测定空气中SO2含量主要用氧化还原反应。已知SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化成SO42-。为测定某地方的空气中SO2和可吸入颗粒的含量,甲同学设计了如下图所示的实验装置:

①其中: 或
或 表示密闭容器;
表示密闭容器; 表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用);
表示气体流速管(单位时间内通过气体的体积恒定,且无除尘和吸收气体作用); 表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
表示棉花;颗粒吸附剂可以吸收可吸入的颗粒;―→表示气体的流向。
②酸性KMnO4溶液体积为200 mL,浓度为0.1 mol·L-1。
回答下列问题:
(1)配制200 mL 0.1 mol·L-1酸性KMnO4溶液,需用到的仪器按使用的先后顺序依次有________、________、________、玻璃棒、________、________。玻璃棒的作用是
____________________________________________________________。
(2)写出并配平测定SO2含量的离子方程式:_______________________________________。
(3)实验中棉花的作用是_____________________________________________________;
若要测定空气中可吸入颗粒的含量(g·L-1),还需要测出的数据是________。
(4)乙同学按照同样的方法测量空气中SO2的含量,所测得的数值总是比实际含量偏低,最可能的原因是(假设溶液配制、称量或量取及各种读数均无错误):____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com