
| A. | S | B. | SO3 | C. | SO2 | D. | H2S |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题

| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应的热化学方程式为:N2(g)+O2(g)=2NO(g)△H=+180 kJ•mol-1 | |
| B. | 1 mol N2(l)和NA个 O2(l)反应生成2mol NO(g)时,吸收的能量为180 kJ | |
| C. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| D. | 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ |
| 物质微粒数 | 固体体积 | 溶液中溶质的质量分数 | 标准状况下气体的摩尔体积 | 非标准状况下某物质的质量 |
| 阿伏加德罗常数 | 固体密度 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
| A. | ①②⑤ | B. | ②③④ | C. | ①④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaOH | C. | Na2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
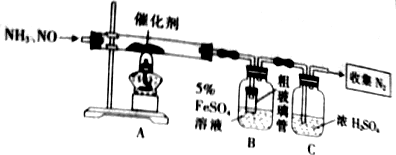
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com